
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Курсовая работа: Розділення і виявлення катіонів Hg(II), Cd(II), Bi(III), Pb(II), Cu(II) методами аналітичної хімії
Курсовая работа: Розділення і виявлення катіонів Hg(II), Cd(II), Bi(III), Pb(II), Cu(II) методами аналітичної хімії
ВСТУП
Аналіти́чна хі́мія — розділ хімії, що розглядає принципи і методи визначення хімічного складу речовини. Виникла поряд із неорганічною хімією раніше від інших хімічних наук. Якісний аналіз визначає ідентичність речовини в даній вибірці; кількісний аналіз визначає, скільки там є даної речовини.
Аналітична хімія складається з двох розділів:
Якісний аналіз - встановлює з яких елементів (або йонів) складається досліджувана речовина.
Кількісний аналіз -встановлює кількісний вміст елементів, йонів чи хімічних сполук, які входять до складу досліджуваних речовин, матеріалів.
Загальні питання аналітичної хімії:
аналітична хімія елементів і сполук;
пробопідготовка;
наукові принципи створення нових аналітичних систем, зокрема сенсорів;
спеціальні види аналізу (локальний, дистанційний, неруйнівний, безперервний у потоці, багатокомпонентний тощо).
Методи аналітичної хімії:
теоретичні основи методів хімічного аналізу;
розроблення нових удосконалення наявних методик аналізу;
методи маскування, розділення і концентрування.
Об'єкти аналізу аналітичний контроль виробництва:
аналіз металів сплавів, неорганічних матеріалів, речовин високої чистоти, органічних речовин, гірських порід та мінеральної сировиниа, об'єктів природного середовища, біологічних об'єктів, лікарських препаратів, харчових продуктів тощо.
1. ОГЛЯД ЛІТЕРАТУРИ ПО ТЕМІ ОБ’ЄКТУ ДОСЛІДЖЕННЯ
1.1 Загальна характеристика металів
1.1.1 Мідь
Мідь - золотисто-рожевий пластичний метал, на повітрі швидко покривається оксидною плівкою, яка додає їй характерний інтенсивний жовтувато-червоний відтінок. Мідь володіє високою тепло- і електропровідністю (20 °C) 16.78 nΩ·m (займає друге місце по електропровідності після срібла). Має два стабільн зотопи - 63Cu і 65Cu, і декілька радіоактивних ізотопів. Самий довгоживучий з них, 64Cu, має період напіврозпаду 12,7 ч і два різні варіанти розпаду з різними продуктами.
Існує ряд сплавів міді: латунь - сплав міді з цинком, бронза - сплав міді з оловом і деякі інші.
У з'єднаннях мідь може мати два ступені окислення: менш стабільний ступінь Сu2+ набагато стабільнішу Сu2+, яка дає солі синього і синьо-зеленого кольору. У незвичайних умовах можна одержати з'єднання із ступенем окислення +3 навіть +5. Остання зустрічається в солях купраборанового аніона Cu(B11H11) 23-, одержаних в 1994 році.
Мідь є необхідним елементом для всіх вищих рослин і тварин. У потоці крові мідь переноситься головним чином білком церулоплазміном.
Всі з'єднання міді токсичні. 30 г сульфату міді є летальною дозою для людини. Вміст міді в питній воді не повинен перевищувати 2 мг/л, проте недолік міді в питній вод також небажаний.
1.1.2 Ртуть
Ртуть - єдиний метал, рідкий при кімнатній температурі. Ртуть не володіє магнітними властивостями.
Ртуть - малоактивний метал (ряд напруг).
При нагріванні до 300 °C ртуть вступає в реакцію до киснем:
2Hg + O2 → 2HgO
Реакція розкладання оксиду ртуті історично є одним з перших способів отримання кисню.
Ртуть застосовується у виготовленні термометрів, парами ртуті наповнюються ртутно-кварцові і люмінесцентні лампи. Ртутні контакти служать датчиками положення. Крім того, металева ртуть застосовується для отримання цілого ряду найважливіших сплавів.
Бромід ртут застосовується при термохімічному розкладанні води на водень і кисень (атомно-воднева енергетика).
Деякі з'єднання ртуті застосовуються як ліки, але в основному із-за токсичності ртуть була витиснена з медицини.
Пари ртуті, а також металева ртуть дуже отруйні, можуть викликати важке отруєння. По класу небезпеки вона відноситься до першого класу (надзвичайно небезпечна хімічна речовина).
1.1.3 Вісмут
Вісмут одержують сплавом сульфіду із залізом:
Bi2S3 + 3Fe = 2Bi + 3FeS
або послідовним проведенням процесів:
Bi2S3+ 5O2 = Bi2O4 + 3SO2;
Bi2O4 + 4C = 2Bi + 4CO.
Вісмут має велике значення для виробництва так званих «автоматних сталей», особливо неіржавіючих дуже полегшує їх обробку різанням на верстатах-автоматах (токарних, фрезерних н.) при концентрації вісмуту всього 0,003 %, в той же час не збільшуючи схильність до корозії.
Деяке значення для виробництва детекторів ядерного випромінювання має монокристалічний йодид вісмуту. Германат вісмуту (BіGO) - сцинтиляційний матеріал, застосовується в ядерній фізиці, фізиці високих енергій, комп'ютерної томографії, геології.
Сплави вісмуту з кадмієм, оловом, свинцем, індієм, талієм, ртуттю, цинком і галієм, володіють дуже низькою температурою плавлення і застосовуються як теплоносії і припої, а так само в медицині як фіксуючі склади для зламаних кінцівок. Деякі легкоплавк сплави застосовуються як елементи протипожежної сигналізації, як спеціальн мастила працюючих у вакуумі і важких умовах, як клапани (при розплавленні тих, що відкривають просвіт для протікання рідин і газів (наприклад ракетних палив).
Із з'єднань вісмуту в медичному напрямі найширше використовують його триокись Bi2O3. Зокрема, її застосовують у фармацевтичній промисловості для виготовлення багатьох ліків від шлунково-кишкових захворювань, а також антисептичних загоюючих засобів.
Оксохлорид вісмуту знаходить застосування в медицині як рентгеноконтрастний засіб і як наповнювач при виготовленні кровоносних судин. Крім того в медицині знаходять широке застосування такі з'єднання вісмуту як: галат, тартрат, карбонат, субсаліцилат, субцитрат, трібромфенолят вісмуту. На основі цих з'єднань розроблена безліч медичних препаратів.
1.1.4 Свинець
Нітрат свинцю застосовується для виробництва могутніх сумішевих вибухових речовин. Теллурід свинцю широко застосовується як термоелектричний матеріал (термо-э.д.с 350 мкВ/К). Азид свинцю застосовується як найбільш широковживаний детонатор (що ніціює вибухову речовину). Перхлорат свинцю використовується для приготування важкої рідини (щільність 2,6) використовуваної в збагаченні, флотації руд, так само він іноді застосовується в могутніх сумішевих вибухових речовинах як окислювач. Фторид свинцю самостійно, а так само спільно з фторидом вісмуту, міді, срібла застосовується як катодний матеріал в хімічних джерелах струму. Вісмутат свинцю, сульфід свинцю, йодид свинцю застосовуються як катодний матеріал в літієвих акумуляторних батареях. Хлорид свинцю як катодний матеріал в резервних джерелах струму. Теллурід свинцю самий широковикористовуючий матеріал у виробництві термоелектрогенераторов і термоелектричних холодильників. Двоокис свинцю широко застосовується не тільки в свинцевому акумуляторі, але так само на її основі проводяться багато резервних хімічних джерел струму, наприклад - свинцево-хлорний елемент, свинцево-плавиковий елемент н.
Свинець і його з'єднання - токсичні. Потрапляючи в організм, свинець накопичується в кістках, викликаючи їх руйнування. ГДК в атмосферному повітрі з'єднань свинцю 0,003 мг/м2, у воді 0,03 мг/л, грунту 20,0 мг/кг. Викид свинцю в Світовий океан 430-650 тисяч т/рік.
1.1.5 Кадмій
Кадмій - сріблясто-білий м'який метал з гексагональними гратами.
Кадмій розташований в одній групі періодичної системи з цинком і ртуттю, займаючи проміжне місце між ними, тому деякі хімічні властивості цих елементів схожі.
Кадмій використовується як компонент твердих припоїв (сплавів на основі срібла, міді, цинку) для зниження їх температури плавлення.
Близько 20 % кадмію йде на виготовлення кадмієвих електродів, вживаних в акумуляторах (нікель-кадмієвих і срібно-кадмієвих), нормальних елементах Вестону, в резервних батареях (свинцево-кадмієвий елемент, ртутно-кадмієвий елемент і ін.
Близько 20 % кадмію використовується для виробництва неорганічних фарбувальних речовин (сульфіди і селеніди, змішані солі, наприклад, сульфід кадмію - кадмій лимонний).
Останніми роками кадмій став застосовуватися при створенні нових протипухлинних наномедикаментів.
Кадмій дуже добре захоплює теплові нейтрони і служить для виготовлення регулюючих стрижнів для атомних реакторів і як захист від нейтронів. Іноді ці властивост використовуються в експериментальних моделях протипухлинної терап Neutron_Capture_Therapy.
Теплопровідність кадмію поблизу абсолютного нуля найвища серед всіх металів, тому кадмій інод застосовується для криогенної техніки.
Пари кадмію, вс його з'єднання токсичні, що зв'язано, зокрема, з його здатністю зв'язувати сірковмісні ферменти і амінокислоти.
Симптоми гострого отруєння солями кадмію - блювота і судоми.
Кадмій - кумулятивна отрута (здатний накопичуватися в організмі).
Ізотопи
З восьми природних ізотопів кадмію шість стабільні, для двох ізотопів виявлена слабка радіоактивність. Це 113Cd (ізотопна поширеність 12,22 %, бета-розпад з періодом напіврозпаду 7,7Ч1015 років) і 116Cd (ізотопна поширеність 7,49 %, подвійний бета-розпад з періодом напіврозпаду 3x1019 років).
1.2 Хроматографія
Хроматографія фізико-хімічний метод розділення і аналізу сумішей, заснований на розподілі їх компонентів між двома фазами - нерухомої і рухомої (елюент), протікаючої через нерухому.
1.2.1 Історична довідка
Історична довідка. Метод розроблений в 1903 М. Кольором, який показав, що при пропусканн суміші рослинних пігментів через шар безбарвного сорбенту індивідуальн речовини розташовуються у вигляді окремих забарвлених зон. Одержаний таким чином пошарово забарвлений стовпчик сорбенту Колір назвав хроматограмой, а метод - Х. Внаслідок термин " хроматограма" стали відносити до різних способів фіксації результатів багатьох видів Х. Однак аж до 40-х рр. Х. не одержала належного розвитку. Лише в 1941 А. Мартін і Р. Синг відкрили метод розподільної Х. і показали його широкі можливості для дослідження білків вуглеводів. У 50-і рр. Мартін і американський учений А. Джеймс розробили метод газорідинно Х.
1.2.2 Основні види хроматографії
Основні види Х. Залежно від природи взаємодії, що обумовлює розподіл компонентів між елюентом нерухомою фазою, розрізняють наступні основні види Х. - адсорбційну, розподільну, онообмінну, екськлюзіонну (молекулярно-ситову) і осадову. Адсорбційна Х. заснована на відмінності сорбуємості речовин адсорбентом, що розділяються (тверде тіло з розвиненою поверхнею); розподільна Х. - на різній розчинност компонентів суміші в нерухомій фазі (високо кипляча рідина, нанесена твердий макропористий носій) і елюенті (слід мати на увазі, що при розподільному механізмі розділення на переміщення зон компонентів частковий вплив робить адсорбційна взаємодія аналізованих компонентів з твердим сорбентом); онообмінна Х. - на відмінності констант іонообмінної рівноваги між нерухомою фазою (іонітом) і компонентами суміші, що розділяється; ексклюзіонна (молекулярно-ситова) Х. - на різній проникності молекул компонентів в нерухому фазу (високопористий неіоногенний гель). Экськлюзіонна Х. підрозділяється на гель-проникну (ГПХ), в якій елюент - неводний розчинник, і гель-фільтрацію, де елюент - вода.
Осадова Х, заснована на різній здатності компонентів, що розділяються, випадати в осад на твердій нерухомій фазі.
Відповідно до агрегатного стану елюенту розрізняють газову і рідинну Х. Залежно від агрегатного стану нерухомої фази газова Х. буває газо-адсорбционною (нерухома фаза - твердий адсорбент) і газорідинної (нерухома фаза - рідина), а рідинна Х. - рідинно-адсорбційної (або твердо-рідинної) і рідинно-рідинної. Остання, як газо-рідинна, є розподільною Х. До твердо-рідинної Х. відносяться тонкошарова паперова.
Розрізняють колоночну і площинну Х. У колоночній сорбентом заповнюють спеціальні трубки - колонки, а рухома фаза рухається усередині колонки дякуючи перепаду тиску. Різновид колоночной Х. - капілярна, коли тонкий шар сорбенту наноситься на внутрішні стінки капілярної трубки. Площинна Х. підрозділяється на тонкошарову паперову. У тонкошаровій Х. тонкий шар гранульованого сорбенту або пориста плівка наноситься на скляну або металеву пластинки; у разі паперової Х. використовують спеціальний хроматографічний папір. У площинній Х. переміщення рухомої фази відбувається завдяки капілярним силам. При хроматографірованн можливо зміна за заданою програмою температури, складу елюента, швидкості його протікання і ін. параметрів.
Залежно від способу переміщення суміші, що розділяється, уподовж шару сорбенту розрізняють наступні варіанти Х.: фронтальний, проявник і витіснювальний. При фронтальному варіанті в шар сорбенту безперервно вводиться суміш, що розділяється, складається з газу-носія і компонентів, що розділяються, наприклад 1, 2, 3, 4, яка сама є рухомою фазою. Через деякий час після початку процесу найменше сорбуючий компонент ,випереджає інші і виходить у вигляді зони чистої речовини раніше всіх, а за ним у порядку сорбіруємості послідовно розташовуються зони сумішей компонентів: 1 + 2, 1 + 2 + 3, 1 + 2 + 3 + 4 (мал., а). При варіанті, проявника, через шар сорбенту безперервно проходить потік елюенту і періодично в шар сорбенту вводиться суміш речовин, що розділяється. Через певний час відбувається ділення початкової суміші на чисті речовини, розташовані окремими зонами на сорбенті, між якими знаходяться зони елюенту (мал., би). При витіснювальному варіанті в сорбент вводиться суміш, що розділяється, а потім потік газу-носія, що містить витіснювач (элюент), при русі якого суміш через деякий період часу розділиться на зони чистих речовин, між якими опиняться зони х суміші (мал., в). Ряд видів Х. здійснюється за допомогою приладів, званих хроматографамми, в більшості з яких реалізується варіант, проявника, Х. Хроматографи використовують для аналізу і для препаратівного (в т.ч. промислового) розділення сумішей речовин. При аналізі розділені в колонц хроматографа речовини разом з елюентом потрапляють через різні проміжки часу у встановлене на виході з хроматографічної колонки пристрій, що детектує, реєструючи х концентрації в часі. Одержану в результаті цього вихідну криву називають хроматограмою. Для якісного хроматографічного аналізу визначають час від моменту введення проби до виходу кожного компоненту з колонки при даній температурі і при використанні певного елюенту. Для кількісного аналізу визначають висоти або площі хроматографічних піків з урахуванням коефіцієнтів чутливості пристрою, що використовуваного детектує, до аналізованих речовин.
Для аналізу розділення речовин, перехідних без розкладання в пароподібний стан, найбільше застосування одержала газова Х., де як елюент (газу-носія) використовуються гелій, азот, аргон і ін. гази. Для газо-адсорбционного варіанту Х. як сорбенту (частинки діаметром 0,1-0,5 мм) використовують силікагелі, алюмогелі, молекулярні сита, пористі полімери і ін. сорбенти з питомою поверхнею 5-500 м2/г. Для газо-рідинного Х. сорбент готують нанесенням рідини у вигляді плівки (висококиплячі вуглеводні, складні ефіри, силоксани і ін.) товщиною декілька мкм на твердий носій з питомою поверхнею 0,5-5 м2/г і більш. Робочі температурн межі для газо-адсорбційного варіанту Х. від -70 до 600 С, для газо- рідинного від -20 до 400 С. Газової Х. можна розділити декілька см3 газу або міліграма рідких (твердих) речовин; час аналізу від декількох секунд до декількох годин.
Х. широко застосовується в лабораторіях і в промисловості для якісного і кількісного аналізу багатокомпонентних систем, контролю виробництва, особливо у зв'язку з автоматизацією багатьох процесів, а також для препаративного (в т.ч. промислового) виділення індивідуальних речовин (наприклад, благородних металів), розділення рідкісних і розсіяних елементів.
Рідинна Х. використовується для аналізу, розділення і очищення синтетичних полімерів, лікарських препаратів, детергентов, білків, гормонів і ін. біологічно важливих з'єднань. Використання високочутливих детекторів дозволяє працювати з дуже малими кількостями речовин (10-11-10-9 г), що виключно важливо в біологічних дослідженнях. Часто застосовується молекулярно-ситова Х. і Х. по спорідненості; остання заснована на здатності молекул біологічних речовин вибірково зв'язуватися один з одним.
1.2.3 Хроматографія речовин в тонких шарах (ХТС)
Є одним з видів розподільної хроматографії. Х. використовуються для аналізу жирів, вуглеводів, білків і ін. природних речовин і неорганічних з'єднань.
Розподільна хроматографія використовує систему "рідина-рідина". Нерухома і рухома рідкі фази практично нерозчинні один в одному. Звідси розподільну хроматографію ноді називають хроматографічним екстрагуванням.
Нерухомою фазою в хроматографії на папері служить сорбована вода (до. 20-25 масс%), що утримується носієм (волокнами целюлози), а рухомою фазою» органічний розчинник, заздалегідь насичений водою.
Процес розділення сумішей на папері не є чисто екстракційним. Тут одночасно вносять свій внесок сорбційні процеси
У випадку утримування носієм фази полярнішої за природою, чим рухома фаза, хроматографічне розділення називають нормальним. Якщо рухома фаза полярніше нерухомої, хроматографічне розділення називають з оберненими, фазами. У останньому випадку на папір накошуватимуть неполярні або малополярні рідини: силіконове або парафінове масло, петролейний ефір, дібутілфталат.
Широке використання розподільної хроматографії на папері обумовлене цілим рядом переваг: доступність, дуже просте апаратурне оформлення, простота проведення аналізу, розділяти можливо мікро- і полумікрокількостях як органічних, так неорганічних речовин.
Якість а швидкість розділення, перш за все, визначаються властивістю використовуваного паперу (хімічна чистота, рівномірна щільність, інертність до дії розчинників, однорідна орієнтація волокон целюлози). По сортах хроматографічний папір відрізняється різною всмоктувальною здатністю. Папір для хроматограф розрізняється по властивостях відповідно до номерів. Номери I і 2 називають "швидкими", а номери 3 і 4- "меду ленними". Швидкість руху розчинника по паперу в сорті "швидкому" вище ніж в сорт "повільному". Аналізуючу речовину наносять на стартову лінію хроматографічного паперу, підсушують і у вертикальному стані смужку паперу поміщають в закриту судину, на дно якої поміщена рухома фаза. Атмосфера камери повинна бути з парами рухомої фази. Капілярними силами рухома фаза піднімається вгору по паперу з поступово уповільнюванною швидкістю (висхідної хроматографії). При рухах в парах паперу рухомий розчинник по-різному захоплює за собою компоненти суміші, що розділяється. Швидкість, з якою розчинник перерозподіляє компоненти суміші між фазами, визначається коефіцієнтом розподілу (Кd ). Чим менша величина Кd, тим швидше речовина просувається по паперу. Розвиток хроматограми припиняють, коли фронт розчинника наблизиться до верхнього краю смужки паперу. Положення фронту відзначають олівцем і папір висушують
Ефект розділення можна встановити декількома шляхами. Якщо плями флуорісцирують, то смужку поміщають в ультрафіолетовий сват. Проявити плями можна в результаті обробки хроматограми відповідним реагентом, що рівномірно наноситься про допомогою пульверизатора
Після закінчення хроматографування та прояву визначають основну характеристику кожного фактор-плями ft, відношення фронтів (Ratio of Fronts).
Rf = Відстань від точки старту до середини плями
Відстань, пройдена розчинником с точки старту
При дотриманн постійних умов хроматографування значення Rf для кожного з'єднання є величиною постійної,, характеристичної. Зміна якої-небудь умови поцесу (якість паперу, чистота розчинника, температура і т.п.) приведе до зміни величини Rf. Якщо величину Rf використовують для ідентифікації невідомої речовини, то доцільно в той час проводити хроматографірувальне з'єднання свідомо, відомого складу (свідок).
Роздільне визначення компонентів можливо, якщо дотримувати умову
∆ Rf ≥ 0,1
На мал..: представлені різні види ізотерм розподілу
для хроматограф на папері, Прямолінійній ізотермі розподілу відповідає кругла форма плями на хроматограмі, а криволінейним-плямоподібна форма.
По нахилу прямолінійної ізотерми розподілу можна зробити оцінку величини
Якщо пряма практично зливається з однією осей (рис. пунктирні лінії) та пляма хроматографіруючого з'єднання або залишається на старті, або переміщається одночасно з фронтом розчинника.

1.2.4 Прилади матеріали в розподільній хроматографії
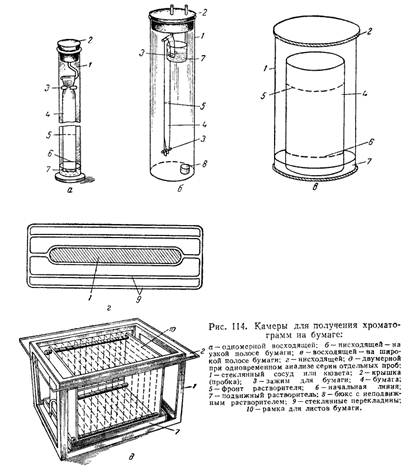
Колоночні хроматограми одержують в скляних колонках, подібних тем, які використовуються в адсорбційно-рідинній хроматографії (див. мал. 111). Для паперової хроматограф застосовують спеціальні установки. Проста установка є скляним циліндром, в який поміщають кювету з розчинником, опустивши в неї один кінець смуги фільтрувального паперу. Найчастіше кювету, що містить розчинник, розташовують так, щоб верхній край паперової хроматограми знаходився в цій кюветі, тобто використовують низхідний потік розчинника. Проте застосовують і висхідний потік розчинника.
2. ПЕРЕЛІК НЕОБХІДНИХ ДЛЯ АНАЛІЗУ ХІМІЧНОГО ПОСУДУ, РЕАКТИВІВ І ОБЛАДНАННЯ
2.1 Хімічний посуд і обладнання
1.Розділова камера
2.Пластинка
3. Мікропіпетка
4. Фільтрувальний папір
5.Скляна пластинка (20х20)
6.Валик
7.Папір для хроматографії
8.

9.
2.2 Реактиви розчини
1.Дистильована вода
2. K2S (1 н)
3. KJ 2-%
4.Al2O3
5.HNO3
6. (NH4) 2S
7.HCl 2-%
8.HCl 1.5-М
9.
10.NH4ОН концентрований
11. М-бутанол
12.Н-бутанол (насичений 1-н розчином HCl)
13.Н-бутанол
14.Ацетон
15.Силуфол
16.Спиртовий розчин NaOH
17.Ацетілацетон
18.Катіони відповідних металів Hg(II), Cd(II), Bi(III), Pb(II), Cu(II)
19.Розчин сол цинку
3. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
3.1 Розділення виявлення катіонів Hg(II), Cd(II), Bi(III), Pb(II), Cu(II) методом одновимірно висхідної ТСХ
Апаратура. Розділова камера є відповідною розміру пластинки з тонким шаром (силуфол) судина, наприклад, звичайний каталізатор з плоским дном. Висота камери при розмірі пластинки 20x20 см приблизно 25 см. Пластинку підтримують у вертикальному положенні за допомогою подставки-стеклянной палички. На задній стінц камери прикріплюють змочену розчинником (рухомою фазою) смужку фільтрувального паперу, що доходить до дна камери, для кращого насичення камери парами розчинника. Зверху камеру закривають пришліфованою кришкою або склом.
Склад рухомо фази: 100 мл н-бутанола, 20 мл 1,5 М HCl і 0,5 мл ацетілацетона, який сприя кращому формуванню плям, зменшенню «хвостів».
Нанесення зразка на пластинку. На пластинку з готовим шаром сорбенту (силуфол) гострою голкою проводять стартову лінію на відстані 2 см від нижнього краю. На стартову лінію наносять тонким капіляром (2 мкл) пробу досліджуваного розчину і проби ндивідуальних компонентів, що входять до складу суміші (мітки, стандарти): по 2 мкл 0,1 М розчин Hg(II), Cd(II), Bi(III), Pb(II), Cu(II). Відстань між краплями повинна бути не менше 1 см. Для надійності ідентифікації компонентів краплі підсушують.
Отримання хроматограми. Пластинку вертикально поміщають в камеру для хромаографірованія. Нижній край занурюють в розчинник не більше ніж на 5 мм. Процес продовжують 1,5-2 ч. Після цього пластинку виймають, відзначають лінію фронту, ретельно підсушують над пісочною лазнею.
Виявлення катіонів. Для виявлення плям хроматограму спочатку обприскують 2%-ним розчином KI, висушують, тримають над парами конц. аміаку, потім обробляють 10%-ним (NH4) 2S. Поява характерного забарвлення плям підтверджує наявність катіона в досліджуваній суміші. Місце виявлення плями відзначають і розраховують Rf. Плями на хроматограмі розташовуються по зменшенню Rf в наступному ряду: Hg(II)> Cd(II)> Bi(III)> Pb(II)> Cu(II).
| Катіон | Проявник | Забарвлення плями |
| Hg(II) | KI | Червона |
| Hg(II) |
(NH4) 2S |
Коричнево- чорна |
| Cd(II) | KI | Жовто- коричнева |
| Cd(II) |
(NH4) 2S |
Коричнево- чорна |
| Bi(III) | KI | Безбарвна |
| Bi(III) |
(NH4) 2S |
Жовта |
| Pb(II) | KI | » |
| Pb(II) |
(NH4) 2S |
Коричнева |
| Cu(II) | KI | » |
| Cu(II) |
(NH4) 2S |
Темно-коричнева |
3.2 Приклади практичного застосування металів
3.2.1 Розділення катіонів міді і кадмію методом тонкошарової хроматографії
Розділення Сu2+ Cd2+ методом тонкошарової хроматографії засновано на використанн відмінності коефіцієнтів розподілу цих іонів між водою і рухомим розчинником. хроматограму проявляють шляхом обприскування проявником - розчином Na2S . У місцях розташування іонів при цьому виникають плями сульфідів, що володіють характерними забарвленнями.
Методика визначення. На скляну пластинку розміром 20 X 20 або 20 X 25 см помішають заздалегідь просіяний безводний окисел алюмінію (розмір частинок не повинен перевищувати 350 меш). Окисел алюмінію або носій розподіляють на пластинц металевим валиком до товщини шару не більше 500 мк. Як рухомий розчинник застосовують суміш, що складається з 18 мл м-бутанола, 12 мл ацетону і 0,6 мл азотної кислоти (р = 1,36 г/см3)
У правий кут приготованої пластинки, на відстані 2 см від краю її, наносять капіляром краплю досліджуваного розчину суміші Сu2+ і Cd2+, що містить кожен іон в концентрації 0,5 г-экв/л. Через 1,5 см по ширині пластинки наносять ще краплю досліджуваного розчину для паралельного досвіду і дал через кожні 1,5 см - по краплі розчину «свідків» (солей кадмію і міді). Таким чином, наносять чотири плями. Діаметр плями, що наноситься, не повинен бути більше 2 мм, інакше розділення іонів буде неповне. Пластинку поміщають в камеру, на дно якої наливають розчинник. Пластинку ставлять в похилому положенні так, щоб шари носія не обсипався з неї, нижній край пластинки обережно занурюють в розчинник на 1 см.
Плями з досліджуваним розчином і «свідками» повинні знаходитися вище за рівень розчинника на 1 см. Камеру закривають і залишають на 50 мін для розвитку хроматограми. Час розвитку хроматограми залежить від вологості носія. Після того, як рухомий розчинник підніметься по тонкому шару носія на висоту не менше 17 см, пластинку виймають, підсушують при кімнатній температурі і проявляють шляхом обприскування 1 н. розчином K2S.
На хроматограме виявляються дві плями: вище - жовте CdS, нижче -черное CuS. Порівнюючи забарвлення одержаних плям від досліджуваного розчину з плямами «свідків», можна визначити зміст Сu2+ и Cd2+ у розчині.
По одержаній хроматограме можна визначити також величину Rf для кожного катіона.
3.2.2 Аналіз суміші катіонів кадмію, міді і ртуті (II)
На папір, що містить в порах нерухомий розчинник - воду, наносять аналізований розчин суміш катіонів і промивають хроматограму рухомим розчинником. Якщо розчинні речовини мають в даній парі розчинників різні коефіцієнти розподілу, то відбувається розділення аналізованих катіонів і виділення їх в різних частинах паперового листа. Шляхом прояву одержаної хроматограми специфічними реагентами визначають речовини, що входять в аналізовану суміш.
Методика визначення. Підготовка паперу. Для аналізу неорганічних речовин може бути використаний «папір для хроматографії» (№ I, 2) і фільтрувальний папір. Заздалегідь папір обробляють, занурюючи її на 30 мін в 0,1 н. спиртний розчин NaOH, потім відмивають від надлишку лугу дистильованою водою і ставлять на 3-4 г в 2%-ний розчин НС1, після чого смужки паперу промивають дистильованою водою і висушують на повітрі.
Розділення катіонів кадмію, міді і ртуті (II). У середину смужки фільтрувального паперу, відповідної розміру камери для отримання хроматограми, на відстані 4-5 см від верхнього краю мікропіпеткою наносять краплю розчину хлоридів міді, кадмію і ртуті (П) в концентрації 10- 15 ме-йон/мл кожного іона. Той же край паперу занурюють на глибину 2-2,5 см в розчинник - н-бутанол, насичений 1 н. розчином НС1. Коли розчинник пройде на папері відстань, рівну 20-25 см, смужку виймають, підсушують при кімнатній температурі і проявляють свіжо приготованим 10%-ним розчином. У низхідній хроматограмі виявляють іони по специфічному забарвленню: внизу розташовується чорна пляма сульфіду ртуті (II), потім темно-коричневе - сульфіду міді і далі жовте - сульфіду кадмію.
Розрахунок. Обчислюють Rf; (мал. 117) аналізованих іонів по наступній формулі:
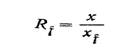
де x - шлях, пройдений компонентом від центру нанесення краплі розчину до центру плями на хроматограмі, см; х< - шлях, пройдений рухомим розчинником від місця нанесення краплі розчину до фронту руху розчинника.
ВИСНОВОК
За результатами виконання курсової роботи з’ясовано, що якісний хімічний аналіз металів Hg(II), Cd(II), Bi(III), Pb(II), Cu(II) базується на явищі хроматографії. Ретельно вивчено явище хроматографії,його класифікація та методи аналізу інших речовин.
Явище хроматографії має велике значення для аналітичної хімії, бо воно застосовуються в хіміко-аналітичних лабораторіях широкого профілю, для визначення найрізноманітніших сполук
Розглянуто методи дослідження даних металів іншими способами. Вивчено їх властивості.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Крешков А.П. Основы аналитической химии. – Т.3. – М.: Химия, 1970. – 472с.
2. Золотов Ю.А. Основы аналитической химии. – М.: Высшая школа, 2001. – 463 с.
3. Кнунянц И.Л. Химическая энциклопедия. – Т.2. – М.:Советская энциклопедия,1988.
4. Коростелев П.П. Химический аналіз в металлургии. – М.: Металлургия,1988. –384с.
5. Некрасов В.В. Руководство к малому практикуму по органической химии. - М.: Химия, 1975. – 327с.
6. Пискарева С.К. Аналитическая химия М.:Высшая школа,1994.-384с.
© 2010 Интернет База Рефератов