
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Дипломная работа: Исследование роста микромицетов на различных источниках углеродного питания
Дипломная работа: Исследование роста микромицетов на различных источниках углеродного питания
ВведениеСреди необходимых для жизни микроскопических грибов элементов углерод занимает совершенно особое положение. Около половины сухого веса микромицета приходится на долю углерода. Этот элемент является постоянной составной частью протоплазмы, ферментов, клеточной оболочки и запасных питательных веществ. Поэтому соединения, содержащие углерод, играют важнейшую роль в питании микроскопических грибов (Лилли, 1957).
Микроскопические грибы значительно различаются способностью усваивать разные соединения углерода и синтезировать из них составные части клетки. Некоторые виды могут использовать для питания разнообразные соединения. С другой стороны, известно множество различных специализированных типов микромицетов, которые нуждаются в специфических соединениях. Нефть, газообразные углеводороды, парафин, воск, резины, гудрон, капрон и многие другие синтетические материалы, а также пестициды после попадания в почву начинают разлагаться плесневыми грибами и бактериями. Практически не существует органических соединений, которые не усваивались бы микроорганизмами.
Любое органическое вещество вначале расщепляется до более простых соединений, а последние вовлекаются в тот или иной биосинтетический процесс. Возникающая при расщеплении энергия накапливается в АТФ или в других соединениях, имеющих макроэргические связи. Таким образом, органические субстраты обеспечивают как энергетическую, так и конструктивную стороны обмена плесневых грибов и бактерий. Следовательно, вопрос об углеродном питании и о влиянии источников углерода на развитие микроорганизмов является очень существенным при проведении любых микробиологических экспериментов (Лилли, 1957).
Целью данной работы является изучение способности использования чистыми культурами микроскопических грибов природных растительных материалов в качестве источника углерода и энергии.
В соответствии с поставленной целью задачей исследования является:
1) определение радиальной скорости роста коллекционных микромицетов при росте на природных растительных материалов (растительный опад, камыш, сено, опилки, кора).
Практическая значимость работы заключается в том, что в настоящее время большой практический интерес вызывают микроорганизмы, в частности микроскопические грибы, участвующие в процессе деструкции природных растительных материалов.
1. Особенности использования углерода микромицетами
1.1 Использование углерода микроскопическими грибами
Соединения углерода используются грибами или как источники энергии, или же для синтеза важнейших составных частей клетки. Иногда на определенном этапе химических превращений оба эти процесса совпадают. Однако после образования некоторых промежуточных соединений, они обычно принимают различное направление. Определение общего количества усвоенного углерода не представляет больших затруднений. Значительные трудности встречаются, однако, при попытках проследить все химические превращения усвоенного соединения углерода в организме.
Баланс углерода. Общее представление о путях усвоения различных источников углерода может быть получено при определении количества выросшего мицелия, выделившейся углекислоты и других продуктов обмена веществ. Если первоначальное количество углерода известно, то его распределение в продуктах обмена веществ можно установить с помощью химических анализов. Обычно в этих опытах удается обнаружить 95 – 99% первоначального количества углерода.
Коэффициент использования. Связь между количеством продуктов обмена веществ, образованных грибов, и количеством использованного углеродистого или какого-либо другого соединения часто выражают математически, в виде отношения. Совершенно очевидно, что такого рода показатели (коэффициенты использования) представляют ценность лишь для данного вида гриба в определенных экспериментальных условиях. Иными словами, эти коэффициенты имеют абсолютное значение лишь для тех условий, в которых они были получены. Определение различных коэффициентов использования представляет не столь большую ценность, как установление полного баланса углерода, но зато оно требует значительно меньше химических анализов. Так как значение этих коэффициентов меняется в процессе развития гриба, то для получения более точных данных они должны определяться несколько раз, через различные интервалы времени после засева среды.
Наиболее широкое распространение из всех этих коэффициентов получил так называемый экономический коэффициент, выражающий соотношение между весом мицелия и спор и весом использованного сахара (или других источников углерода). Для этого по окончании опыта определяют оставшееся неусвоенным количество углерода в среде. Грибы, обладающие достаточной биохимической активностью, превращают приблизительно половину сахара, содержащегося в среде, в составные части клетки. Эффективность превращения веществ большинством грибов, культивируемых на лабораторных средах, значительно меньше. Это отчасти зависит от неправильного соотношения различных питательных веществ в среде и от характера углеродного обмена. Углерод, не использованный для синтеза мицелия, превращается в углекислоту и в промежуточные продукты обмена веществ, например спирт или органические кислоты. В промышленности стараются создать такие условия культивирования, при которых возможно большее количество углерода идет на образование нужного промежуточного продукта обмена и возможно меньшее количество расходуется на синтез мицелия и образование углекислоты.
Промежуточный обмен веществ. Усваиваемость различных источников углерода данным видом гриба определяется в основном структурой молекул этих соединений. Использование сложных природных соединений, например, полисахаридов, возможно лишь в том случае, если гриб способен синтезировать и выделять в среду необходимые гидролитические ферменты. Использование простых соединений, например, моносахаридов, также состоит из ряда следующих одна за другой ферментативных реакций обмена веществ. Известно, что химический состав гриба почти не зависит от использованного им источника углерода. Таким образом, на определенных этапах процесса синтеза различные исходные источники углерода превращаются в одинаковые соединения. Очень возможно, что эти исходные соединения углерода превращаются в одинаковые промежуточные продукты обмена веществ еще до начала синтеза (Капутто, 1949).
Промежуточные продукты обмена веществ должны, без сомнения, служить возможным источником углерода для гриба, который способен их образовывать. Если гриб превращает соединение А в соединение Б, то это последнее также должно служить возможным источником углерода для данного гриба. Неспособность гриба усваивать соединение Б указывает на то, что это соединение не является в действительности промежуточным продуктом обмена веществ. Однако в этой простой гипотезе не учитываются две следующие возможности: во-первых, соединение Б может проникать в клетку гриба не столь легко, как соединение А, и, во-вторых, соединение Б в испытываемых концентрациях может быть ядовито для гриба.
Нередко промежуточные продукты диссимиляции сахаров поступают в среду, из которой их можно затем выделить. Так, наличие ацетальдегида устанавливают, добавляя к среде бисульфит. Ацетальдегид образует с бисульфитом нерастворимое соединение. Иногда накопление определенного промежуточного продукта в среде обуславливается замедленным протеканием следующего этапа обмена веществ. В этих случаях промежуточные продукты обмена веществ, подвергаясь дальнейшим превращениям, со временем исчезают из среды. К таким промежуточным продуктам обмена веществ относятся ацетальдегид, этиловый спирт и пировиноградная кислота.
Нельзя утверждать, что усвоение сахара или какого-либо иного источника углерода происходит одинаково у всех видов грибов. Нет также никаких оснований предполагать, что у данного вида гриба существует лишь один путь усвоения углеводов. Nord F.F. и Mull R.P. (1945) считают, что диссимиляция углеводов различными видами Fusarium может происходить в результате окисления, в результате разрыва углеродной цепочки или, наконец, с участием реакций фосфорилирования. Относительная значимость этих трех процессов диссимиляции сахаров зависит от вида гриба и от внешних условий. Образование двумя различными видами грибов одинакового промежуточного продукта обмена веществ не является еще доказательством того, что в обоих случаях механизм образования этого продукта одинаков. Так, дрожжи и некоторые виды Fusarium образуют спирт, однако биохимические процессы, в результате которых эти микроорганизмы превращают глюкозу в спирт, различны (Лилли, 1957).
1.2 Использование микромицетами различных природных веществ в качестве единственного источника углерода
1.2.1 Разложение целлюлозы
Целлюлозолитические системы, состав и активность их отдельных компонентов, продуцируемые различными микроорганизмами, варьируют в широких пределах. В настоящее время наиболее перспективными продуцентами целлюлаз с точки зрения промышленного использования являются грибы следующих родов: Aspergillus, Coriolus, Eupenicillium, Fusarium, Penicillium, Physarium, Sporotrichum, Trichoderma, Verticillium.
Среди грибов, способных расщеплять кристаллическую целлюлозу, только некоторые продуцируют полные внеклеточные целлюлолитические системы (эндо- и экзоглюканазы, β-глюкозидазу). Среди них Trichoderma viride, T. reesei, T. koningii, Penicillium funiculosum, Fusarium solani. Для культуральной жидкости большинства других грибов этой группы характерно отсутствие экзоглюканазы, то есть эти грибы могут деградировать более аморфные формы целлюлозы.
Деградация высокоупорядоченной формы целлюлозы осуществляется благодаря синергическому действию комплекса целлюлолитических ферментов. При любой комбинации экзо- и эндоглюканаз Trichoderma koningii, Fusarium solani, Penicillium и Funiculosum отмечается выраженный синергизм. Однако синергизм между экзоглюканазами этих грибов и эндоглюканазами грибов, не продуцирующих экзоглюканазу (Myrothecium verrucaria), не выявлен. Нет также синергизма между экзоглюканазами грибов и эндоглюканазами рубцовых бактерий. Последнее указывает на существенные различия целлюлолитических систем грибов и бактерий.
В природе в процессе фотосинтеза производится большое количество целлюлозы, в результате возникли многие виды целлюлолитических микроорганизмов. В почве целлюлозная и гемицеллюлозная части биомассы разлагаются интенсивнее, чем лигнин, и быстро метаболизируются почвенными микроорганизмами. Показано, что целлюлаза из Trichoderma viride образует с гуминовыми кислотами комплекс, стабильный в почвенных условиях. При внесении азота в почву разложение лигнина и целлюлозы ускоряется. Добавление глюкозы вызывает обратный эффект. Окончательный продукт деградации целлюлозы – углекислый газ, но если процесс протекает в анаэробной среде, образуется также метан (Марьиновская, 2006).
Содержание целлюлозы в древесном опаде составляет 34 – 59%, несколько меньше содержание гемицеллюлоз и пектина (Мирчинк, 1988).
Целлюлоза является линейным полимером d-глюкозы. Остатки глюкозы в молекуле клетчатки, как и в молекуле целлобиозы связаны β-гликозидной связью. Поэтому клетчатку можно рассматривать как полимер целлобиозы. Norman A.G. и Fuller W.H. (1942) считают, что большинство грибов способно усваивать клетчатку. Несмотря на то, что использование клетчатки грибами имеет большое значение в круговороте веществ в природе, процесс этот изучен далеко не полно.
Campbell W.G. высказал предположение, что первым этапом использования клетчатки грибами является не гидролиз, а окисление. Гидролиз клетчатки можно схематически представить следующим образом клетчатка→целлодекстрины→целлотетроза→целлобиоза→d-глюкоза. Ферменты грибов, расщепляющие целлюлозу еще мало изучены.
Способность грибов усваивать клетчатку колеблется в очень широких пределах. В общем, усвоение клетчатки происходит медленнее, чем усвоение глюкозы. Это обуславливается, по всей вероятности, нерастворимостью клетчатки, в связи с которой действие целлюлазы ограничено поверхностью вещества. Возможно также, что синтез целлюлазы происходит сравнительно медленно (Лилли, 1957).
Основными источниками клетчатки для грибов в природных условиях служат древесина и различные растительные остатки. Хотя основной частью древесины и растительных остатков является именно клетчатка, тем не менее в них, помимо клетчатки, всегда содержатся гемицеллюлоза, камеди, таннины и лигнин. Грибы, разрушающие древесину, обычно подразделяют на виды, вызывающие белую гниль, и виды, вызывающие коричневую гниль. Грибы – возбудители коричневой гнили разрушают предпочтительно клетчатку. Грибы, разрушающие неклетчатковые составные части растительных тканей, вызывают белую гниль. Виды, относящиеся ко второй группе, по-видимому, значительно более многочисленны, чем виды грибов, вызывающие коричневую гниль. По данным Ноблеса М.К. (1948), к грибам, вызывающим белую гниль, относятся следующие виды: Armillaria mellea, Ganoderma lobatum, Lenzites betulinus, Pleurotus ostreatus, Polyporus abietinus, P. cinnabarinus, P. pargamenus. К немногим видам, вызывающим коричневую гниль, принадлежат: Daedalea quercina, Lentinus lepideus, Lenzites trabea, Merulius lacrymans и Trametes americana (Лилли, 1957).
1.2.2 Разложение крахмала
Как и целлюлоза, крахмал является полимером d-глюкозы. Остатки глюкозы в его молекуле соединены между собой α-гликозидной связью, поэтому основной структурной единицей молекулы крахмала, как и молекулы гликогена, следует считать мальтозу. Крахмал состоит из двух различных соединений. Молекулы одного из них, называемого амилазой, имеют неразветвленную углеродную цепочку, тогда как другое соединение, с разветвленной углеродной цепочкой, получило название амилопектина. Зеленые растения синтезируют крахмал, животные и грибы образуют гликоген. Ферментативный гидролиз крахмала может быть схематически представлен следующим образом: крахмал→декстрины→мальтоза→d-глюкоза. Декстрины, имеющие разветвленную углеродную цепочку, лишь частично гидролизуются амилазой. Декстрины с неразветвленной углеродной цепочкой полностью превращаются в мальтозу (Мирбек, 1948).
Крахмал нерастворим в воде. Лишь грибы, образующие амилазу, обладают способностью усваивать крахмал. Существует немало грибов, неспособных развиваться на средах с крахмалом, однако большинство из них может усваивать этот полисахарид. Волконский (1934) установил, что 26 различных изученных им видов и штаммов оомицетов из числа сапролегниевых усваивали как крахмал, так и продукты его гидролиза (декстрины, мальтозу и глюкозу), но не были способны ассимилировать 13 других источников углерода, включая сюда и фруктозу. Позднее Марголин (1942) показал, что 19 из 21 вида грибов, усваивающих мальтозу, обладали также способностью использовать и декстрин (Лилли, 1957).
1.2.3 Разложение гемицеллюлоз
Гемицеллюлозы полисахариды, сахара и уроновые кислоты – присутствуют во всех растительных тканях. Ксилан, относящийся к гемицеллюлозам, – полимер ксилозы, занимает по количеству в растениях второе место после целлюлозы. В древесине хвойных его 12%, лиственных деревьев – до 25%.
Разложение гемицеллюлоз – процесс неспецифический и осуществляется многими микроорганизмами. Большое место в этом процессе занимают грибы, в частности фермент ксиланаза есть у многих грибов, как микромицетов, так и высших базидиальных грибов, многие из которых являются типичными сапротрофами на растительном опаде (Мирчинк, 1988).
1.2.4 Разложение пектиновых веществ
Среди грибов имеются активные разлагатели пектина, который также является существенным компонентом растительного опада. Пектин образует в растениях межклеточное вещество, из которого состоят так называемые срединные пластинки, соединяющие между собой отдельные клетки растения. Они придают тканям прочность. Пектин представляет собой высокомолекулярное соединение углеводной природы – полисахарид, в котором метоксилированные остатки галактуроновой кислоты связаны между собой β-1,4-глюкозидными связями.
В растениях пектиновые вещества присутствуют в виде нерастворимого протопектина в соединения с другими полисахаридами клеточной оболочки.
Действие пектиназ проявляется в размягчении ткани и распаде ее на отдельные клетки. Существует несколько типов ферментов-пектиназ в зависимости от специфики их воздействия на субстрат: протопектиназы вызывают превращение нерастворимого протопектина в растворимый протопектин, расщепляют связи между метоксилированной полигалактуроновой кислотой и связанным с ней арабаном и ксиланом; пектинэстеразы гидролизуют метоксильные молекулы растворимого пектина (гидролитическое отщепление метоксильных групп от растворимого пектина), в результате чего образуется полигалактуроновая кислота и метиловый спирт; полигалактуроназы гидролизуют β-1,4-глюкозидные связи пектиновой кислоты до свободных галактуроновых кислот. Встречаются главным образом у различных видов бактерий и грибов.
Многие грибы образуют пектинолитические ферменты. Высокая пектинолитическая активность обнаружена у некоторых эпифитных грибов, главным образом Aureobasidium pullulans и видов Cladosporium. Пектинолитические грибы занимают значительное место среди типичных представителей лесной подстилки – это виды родов Cladosporium, Alternaria, Aposphaeria, Penicillium, фитопатогенные грибы родов Fusarium, Verticillium, Botrytis cinerea, Sclerotinia sclerotiorum.
Ферментативное разрушение пектиновых веществ в растениях имеет значение в патогенезе некоторых заболеваний. Фитопатогенные грибы разрушают пектин срединной пластинкой и пектаты в первичных клеточных оболочках, что приводит к изменению их физико-химических свойств и создает условия для внедрения паразита, а также в результате действия пектинэстеразы образуются вещества – полигалактурониды, способные закупоривать сосуды, что в конечном итоге приводит к увяданию растений.
Существенное значение разрушения пектиновых веществ грибами имеет при разложении растительного опада. Практическое использование пектиназ грибов – применение в пищевой промышленности при приготовлении фруктовых соков для их осветления, а также при мочке льна (Мирчинк, 1988).
1.2.5 Разложение лигнина
Грибы почти единственные разрушители лигнина. Способность грибов осуществлять глубокое разрушение лигнина представляет собой уникальное явление.
Лигнин наиболее распространенное в природе полимерное циклическое соединение. В наибольшем количестве лигнин содержится в древесине и древесном опаде. Содержание его в опаде хвойных пород составляет 28 – 34%, лиственный пород – 18 28%. В химическом отношении лигнин не является индивидуальным веществом с вполне определенными свойствами и составом.
Исследования, касающиеся микробной деградации лигнина, относятся к одной из наиболее сложных биологических проблем, поскольку лигнин пока не может быть точно определен как химическое вещество. Также не могут быть точно определены и промежуточные реакции его биологического превращения. Наиболее активные группы микроорганизмов, разрушающих лигнин, принадлежат к древоразрушающим базидиомицетам, вызывающим белую гниль. Однако до настоящего времени неизвестны полностью все стадии ферментативных реакций в процессе разложения лигнина, то есть известны далеко не все ферменты, осуществляющие этот процесс.
Отличия деградации лигнина от деградации других полимеров заключается в том, что такие полимеры, как протеины, полисахариды, нуклеиновые кислоты, состоят из регулярно повторяющихся единиц, в то время как лигнин состоит из различных мономеров, имеющих различные типы связей. Большинство микроорганизмов, воздействующих на лигнин, вызывают в нем очень незначительные изменения, которые проявляются в основном в уменьшении числа метоксильных групп и очень слабой потере в весе. Некоторые сумчатые и несовершенные грибы могут расти на средах, содержащих препарат лигнина в качестве единственного источника углерода, такие, как Fusarium lactis, F. nivale и некоторые другие, но они не вызывают существенных изменений в молекуле лигнина. Вещества, представляющие собой производные лигнина, – ванилин, сиреневый альдегид и другие, используются грибами родов Chaetomella, Coniothyrium, Cylindrocarpon, Torula, Hormiscium.
Исследования последних лет показывают, что полное разложение лигнина с разрушением ароматического кольца могут осуществлять только базидиальные древоразрушающие грибы, вызывающие белую гниль: Coriolus versicolor, Fomes fomentarius, и некоторые подстилочные базидиомицеты, такие, как виды родов Collybria, Marasmius, Mycena.
Высокая молекулярная масса и низкая растворимость лигнина препятствуют его прямой ассимиляции микроорганизмами. Предварительно происходит его расщепление экзоферментами во внешней среде. Своеобразное химическое строение лигнина делает его труднодоступным для ферментных систем микроорганизмов. Многие микроорганизмы обладают ферментными системами, способными к превращению простых ароматических соединений. Однако полизамещенные ароматические соединения мономеры лигнина – доступны лишь немногим представителям отдельных родов, так как для их разложения требуются весьма редкие у микроорганизмов ферменты деметилирования и декарбоксилирования ароматических структур. Необычен для микроорганизмов и характер связей между мономерами, некоторые из них не имеют аналогий среди соединений, типичных для живой клетки. Они совершенно недоступны для ферментов – деполимераз микроорганизмов, легко разрушающих белковые, полисахаридные, полинуклеиновые молекулы.
Способность многих грибов разлагать клетчатку и лигнин определяет их активное участие в разложении растительного опада. В растительном опаде в древесине лигнин и целлюлоза образуют природный комплекс, в котором его составляющие структурно и химически связаны между собой. Разложение лигноцеллюлозного комплекса грибами установлено серией экспериментов по разложению растительного опада, проведенных В.Я. Частухиным. Он разработал специальную методику для лабораторного изучения процессов распада, которая позволила создать модель процессов, происходящих в природе, в условиях точно контролируемых опытов.
По характеру воздействия на опад выделяют три группы подстилочных сапротрофов (Мирчинк, 1988):
I группа – грибы, преимущественно разлагающие клетчатку, – Lepiota procera.
II группа – грибы, преимущественно разлагающие лигнин, – Phallus impudicus.
III группа – грибы, осуществляющие смешанное воздействие, – Collybria, Marasmius, Clitocybe.
Г. Линдбергом были проведены опыты по определению интенсивности разложения целлюлозы и лигнина подстилочными сапротрофами, принадлежащими к различным видам Marasmius, непосредственно в растительном опаде с точным учетом исходного и конечного содержания этих продуктов в субстрате. Почти все виды Marasmius оказались способными разлагать лигнин, но интенсивность разложения лигнина у разных видов различна. Также было различным отношение количеств разложенных лигнина и клетчатки. Таким образом, внутри рода Marasmius можно выделить группы, преимущественно разлагающие лигнин, клетчатку или оба компонента вместе (Мирчинк, 1988).
1.2.6 Разрушение грибами древесины
Различные грибы разрушают мертвую древесину живых деревьев, проникая в центральный цилиндр чаще всего через поражения коры. Другие виды заселяют преимущественно заготовленную древесину, а некоторые даже специализируются на деревянных постройках. Повреждения ими отрицательно влияют на прочность (важную в строительстве) и внешний вид (фанеровка) материала.
Как субстрат древесина содержит лишь следы доступных питательных веществ. Разложение клеточных стенок требует особых ферментов. Недостаток кислорода, высокое содержание двуокиси углерода, неизбежно образуемой организмами во время роста, а также низкая влажность среды осуществляют дальнейший жесткий отбор соответствующих грибов, из которых большинство относится к базидиомицетам; на древесине встречаются и аскомицеты, в том числе вызывающие ее окрашивание.
Большой практический интерес вызывают в настоящее время грибы, разрушающие лигнин, лигноцеллюлозу и целлюлозу; наряду с этим повреждения грибами древесины всегда требовали огромного внимания. Профилактические меры принимаются на всех этапах ее заготовки: рубка в холодное время, ускоренная распиловка на бревна и доски, предпочтение пород с твердой более устойчивой к грибам древесиной, аэрируемое хранение при максимальном снижении контакта пиломатериалов с почвой и друг с другом в штабелях. Древесину, которая будет подвергаться воздействию неблагоприятных погодных условий, особым образом пропитывают, а в строительном деле часто дополнительно защищают путем покраски, обжигания или лакировки (Мюллер, 1995).
Участвуя в разложении многих углеродсодержащих веществ растительного опада и древесины в первую очередь трудноразлагаемых полимерных соединений, где грибам принадлежит ведущая роль, они занимают значительное место в круговороте углерода, являясь поставщиками СО2 в атмосферу.
Среди грибов есть организмы, разлагающие жиры и воска, входящие в состав растительных и животных тканей. Это определяется наличием у них ферментов липаз. Наибольшей активностью липолитических ферментов обладают виды Mucor lipolyticus, Rhizopus nigricans, Aspergillus niger, Penicillium verrusum, Penicillium roquefortii. Многие выделены с поверхности растений, являясь эпифитами и способны разлагать также восковые налеты на поверхности растений.
Известна также способность грибов разлагать как алифатические, так и ароматические углеводороды. В этом отношении наибольшей активностью характеризуются грибы рода Aspergillus (Мирчинк, 1988).
1.2.7 Разрушение грибами текстиля и сходных изделий
Шерсть, лен, хлопок, кожа, как и практически все прочие материалы растительного и животного происхождения, могут ферментативно разрушаться грибами. Чаше всего это аскомицет Chaetomium globosum (Sphaeriales), Myrothecium, Trichoderma и многие другие Fungi imperfecti (Aspergillus, Penicillium, Alternaria, Stemphylium, Gliocladium, Cladosporium). Наиболее важны здесь обладающие высокой ферментативной активностью, быстрорастущие убиквисты, тогда как специализированные Basidiomycota преобладают лишь в особо благоприятных для них условиях.
Для своего роста и разрушающего действия эти неприхотливые грибы нуждаются в минимуме влажности. Если такое условие выполнено, они заполняют также бумагу, веревки и сходные материалы, бедные питательными веществами.
При разложении природных макромолекул грибы предпочтительны из-за высокой ферментативной активности; к тому же их целлюлазы и другие ферменты чаще, чем у бактерий, выделяются из клеток.
Эти свойства грибов можно использовать при получении «биогаза» на предварительной стадии разрушения полимеров и для рециклизации отходов – бытового мусора (Мюллер, 1995).
1.2.8 Разрушение грибами нефтепродуктов
В последние десятилетия в связи с возродившимся интересом к процессам микробного превращения углеводородов были обнаружены мицелиальные грибы, деятельность которых приводит к деструкции нефти и ее производных. В настоящее время доказано, что утилизировать нефтепродукты, в том числе различные топлива, во время хранения и транспортировки способны многие виды грибов и бактерий (Андреюк, 1980).
Нефтепродукты как среда обитания грибов характеризуются рядом особенностей: 1) содержат большое количество сравнительно доступного углерода и минимальное – азота при почти недоступном пространственном расположении его в молекуле; 2) в них почти отсутствует доступная активная вода. Это оказывает существенное влияние на синтез de novo грибной клетки.
Вопросы необходимого соотношения C:N у грибов при росте на нефтепродуктах в биохимическом аспекте исследованы еще мало и уровень этих данных уже не отвечает современным представлениям о возможностях грибной клетки. Очевидно, здесь имеет место не только типичный гетеротрофный процесс, но также определенное подобие хемотрофии и автотрофии, причем стадии роста отличаются и специфичны по способности к разным типам трофики. Особенно это проявляется в период формирования репродуктивных структур (Малашенко, 1987).
Спецификой роста грибов на нефтепродуктах является их способность распространяться на поверхности, то есть возможность использовать при этом активную воду из воздуха, а также расти в толще нефтепродуктов, то есть ограничивать свои потребности в воде за счет активной воды самих нефтепродуктов (Жданова, Василевская, 1982).
Рост грибов (кладоспориев, пенициллиев, аспергиллов и некоторых других видов и штаммов) в разных нефтепродуктах характеризуется различным типом размещения мицелиальной пленки. Наиболее типичный – на разделе фаз, однако чаще всего наблюдается еще и глубинный рост, при котором развивается не только в толще жидкости – до 20 см. Причем интересно, что рост этих штаммов при определенном соотношении нефтепродуктов и воды мало зависит от высоты слоев смеси, а также воздуха в надсубстратном пространстве. Это свидетельствует о большой возможности мицелиальных грибов выдерживать жесткие условия и приспосабливаться к потреблению необходимых для метаболизма веществ не совсем обычными биохимическими и физиологическими путями.
В настоящее время установлено, что способность окислять углеводороды нефти не является специфической чертой отдельных видов грибов. Это не редкая их особенность, а одна из физиологических функций. Однако, несмотря на большое сходство химических и физических свойств фракций нефтепродуктов, у большинства видов грибов четко проявляется избирательное отношение к их утилизации (Бабьева, 1983).
1.2.9 Разрушение полимерных материалов
Синтез полимеров и создание на их основе материалов, обладающих повышенной стойкостью к факторам окружающей среды и воздействию различных организмов, привел к обострению экологической обстановки из-за накопления больших объемов отходов, содержащих эти соединения в разных отраслях промышленности. В последние десятилетия во многих странах уделяется большое внимание созданию полимерных материалов и их модификаций, утилизация которых возможна под воздействием микробиоты. В качестве добавок к пластификаторам исследователи используют природные компоненты такие, как крахмал, производные целлюлозы, протеин, хитозан и так далее. На основе этих композитных полимеров ряд фирм выпускает пластики для производства изделий разового пользования, упаковки пищевых продуктов, плоских пленок и так далее, которые обладают способностью к биодеградации при компостировании и так далее (Власова, 2001; Фомин, 2001). Состав микроорганизмов, контаминирующих техногенные материалы и способных вызывать их биодеградацию, очень разнообразен как в таксономическом отношении, так и по их физиолого-биохимической активности. Среди них ведущее место занимают представители дейтеромицетов, способные развиваться на обширном сортименте материалов, содержащих соединения как природного происхождения, так и искусственного синтеза (Биоповреждения, 1987; Коваль, 1989).
Было проведено исследование О.В. Сычуговой с соавторами (2003) с целью изучения возможности роста и развития видов микромицетов на композиции пленочного сополимера этилена и винилацетата с термопластичным крахмалом.
В процессе данного исследования оценка возможности потребления разных форм крахмала тест культурами показала, что они способны утилизировать данный источник углеродного питания. Однако динамика роста видов на разных средах при одинаковых условиях инкубации, при одной и той же навеске крахмала не одинакова, что особенно четко проявляется на 4–10-е сутки. Выявляется и некоторая разница в темпе роста видов грибов на нативном и растворимом крахмале разного происхождения, а также на средах Чапека и Гетченсона, взятых в качестве контроля (Сычугова, 2003).
Изменения морфологических признаков и образования новых структур у тест – культур на модифицированных средах при замене сахарозы на крахмал и росте на полимере не отмечаются, и они сопоставимы с параметрами, приведенными в определителях (Пидопличко, 1953; Ellis, 1971; Watanabe, 2000). Отличия выявлены у них только в темпах формирования морфологических структур. Хотя в литературе и приведены данные о влиянии субстрата на появление новых морфологических структур у грибов (Богомолова, 2001), однако, вероятнее всего, онтогенез и темпы развития определяются геномом вида, реализация программы которого зависит от влияния различных факторов (Шевцова, 1987; Долгова, 1997).
На поверхности пленки, содержащей термопластичный крахмал фиксируются сформированные пучки конидиеносцев Aspergillus niger, Paecilomyces variotii, Penicillium funiculosum, Chaetomium globosum, Trichoderma viride. Другие виды из взятого набора тест-культур не растут на данном субстрате или формируют слабое спороношение и в более поздние сроки.
Рост мицелия и формирование спороношения на композиции пленочного сополимера дает основание предполагать участие некоторых видов грибов в биодеструкции полимера из сополимеров этилена и винилацетата (СЭВА) с добавлением термопластичного крахмала (ТПК). Это дает возможность при последующих пересевах на смесях СЭВА и ТПК отобрать наиболее активные виды и их штаммы для разработки биотехнологии по его утилизации (Сычугова, 2003).
Таким образом, микроскопические грибы могут использовать в качестве источников углерода разнообразные органические вещества, тем самым являясь важными деструкторами различных природных материалов: целлюлозы, крахмала, лигнина, гемицеллюлозы, жиров, углеводородов, а также синтетических материалов, таких как пластики, пленки, упаковки пищевых продуктов и так далее.
2. Объекты и методы исследований
2.1 Объекты исследований
В качестве объектов исследования были выбраны коллекционные штаммы микромицетов: Aspergillus flavus, A. fumigatus, Alternaria sp., Penicillium sp., Cladosporium sp., Trichoderma sp., Verticillium sp. Культуры были взяты из коллекции культур микроорганизмов кафедры «Прикладная биология и микробиология» АГТУ. Данные виды микромицетов были выделены из основных типов почв Астраханской области и из растительных субстратов: Aspergillus flavus и A. fumigatus из бурой полупустынной почвы Орловского смешанного леса, Alternaria sp. и Cladosporium sp. – из листьев клубники, Cladosporium sp. – из каштановой почвы Дубового леса, Trichoderma sp., Verticillium sp. – из каштановой почвы Ясеневого леса.
2.2 Отбор и подготовка почвенного образца
Образцы почв для микробиологических исследований отбирают в стерильные пергаментные пакеты, полиэтиленовые пакеты или стеклянную посуду.
При отсутствии возможности анализировать образцы непосредственно после сбора, их в течение нескольких часов высушивают на воздухе, предохраняя от прямых солнечных лучей.
При подготовке почв к микробиологическому анализу необходимо провести следующие операции: очистить от камней, трав; разрушить почвенные агрегаты, используя метод растирания почвы в стерильной фарфоровой чашке пестиком (Градова, 2001).
2.3 Методы выделения плесневых грибов
При выявлении и учете микромицетов производят посев из разведения почвенной суспензии на плотные питательные среды. Наиболее часто используют подкисленные молочной кислотой, сусло – агар и синтетические среды с простыми углеводами (например, среда Чапека). Подкисление производят для того, чтобы убить бактерии.
При выявлении грибов, которые не развиваются на кислых средах, используют красители: бенгальский розовый, кристаллический фиолетовый, малахитовый зеленый. Применяют также комбинации из красителей и антибиотиков.
Грибы, которые не выдерживают конкуренцию за моносахара, выделяют на «голодные среды» водный агар, агар с почвенной вытяжкой, агар с разведенным в 8–10 раз суслом. На этих средах микромицеты развиваются значительно медленней и образуют мелкие колонии. При выделении микромицетов, разлагающих целлюлозу, лигнин, гумусовые вещества, источник углерода добавляют к синтетической минеральной среде (Бабьева, 1989).
2.4 Методы идентификации плесневых грибов
Культуральные признаки грибов описывают на плотных питательных средах в чашках Петри. При описании культуральных признаков грибов отмечают внешний вид колоний, текстуру колоний (бархатистая, шерстистая, шероховатая, войлочная), окраску колоний, диффузию пигмента в агар, складчатость колонии, наличие экссудата.
Для характеристики морфологических признаков сначала рассматривают чашки при малом увеличении, а затем готовят микроскопический препарат – раздавленная капля (Бабьева, 1989).
Идентификация мицелиальных грибов основана главным образом на сопоставлении макроскопических и микроскопических признаков исследуемой культуры с ранее описанными признаками известных грибов. Для каждой идентифицируемой культуры необходимо определить цвет поверхности (у некоторых организмов и обратной стороны) и фактуру колоний, а также скорость роста по диаметру колоний (макроскопические признаки). Дальнейшая работа по идентификации связана с приготовлением препаратов репродуктивных органов: необходимо отмечать характер септирования гиф, тип конидиогенных клеток и вид их репродуктивных пропагул. Принадлежность грибов устанавливают по наличию разнообразных конидиальных спороношений как открытых, так и внутри специальных вместилищ – пикнид и отсутствии каких-либо половых спороношений. Применяемая на практике идентификация основана в основном на морфологических признаках конидиального спороношения, которые чрезвычайно разнообразны. Принадлежность к классу и роду устанавливают по определителям (Егоров, 1986; Билай, 1987; Саттон, 2001; Еремеева, 2007; Booth, 1971; Pitt, 1991; Klich, 1992).
2.5 Принципы составления питательных сред для грибов. Основные принципы композиции сред
При составлении питательных сред для грибов обычно пользуются результатами предварительных исследований по выяснению значения для роста и развития изучаемого объекта концентрации отдельных компонентов (источников углерода, азота, зольных веществ и витаминов).
Основными правилами, которых придерживаются при составлении сред, способствующих росту грибов, являются следующие:
1) целесообразно применять отдельные источники углерода и азота;
2) концентрация вещества, служащего источником азотного питания, должна сильно уступать концентрации вещества – источника углерода (примерно в 10 – 15 раз).
Хотя среды натурального происхождения более благоприятны для роста большинства грибов, однако при физиологических экспериментах по изучению развития и обмена у грибов использовать их нежелательно, так как их состав непостоянен. Для этих экспериментов обычно используются синтетические среды. Одной из первых синтетических сред для грибов (культур видов аспергиллов и пенициллов) была среда Роллена следующего состава (г/л):
сахароза 72 (около 5%);
винная кислота – 4,0 (для подкисления среды);
фосфорнокислый аммоний – 4,0;
углекислый калий – 0,6;
сернокислый аммоний – 0,25;
сернокислый цинк – 0,07;
сернокислое железо – 0,07;
кремнекислый калий – 0,07;
дистиллированная вода – 1,5 л.
Более простой состав имеет среда Чапека (г/л):
сахароза – 30,0;
NaNO3 – 2,0;
MgSO4 – 0,5;
FeSO4 – 0,01;
KH2PO4 – 1,0;
KCl – 0,5;
дистиллированная вода – 1,0 л.
Для многих грибов указанные здесь среды являются неполноценными. Некоторые грибы (особенно витаминозависимые) растут на них плохо или совсем не растут. В таких случаях, если потребность данного организма в витаминах не изучена, необходимо добавлять в среду экстракты растительных или животных тканей, выбирая их исходя из экологии данного гриба. Например, в среды для выращивания грибов дереворазрушителей добавляют опилки из древесины той породы дерева, которую они поражают в природе, для выращивания грибов – паразитов растений – ткани растения – хозяина; выращивание грибов – копрофилов производится на средах с навозным экстрактом (Беккер, 1983).
2.6 Приготовление питательных сред
Посуда для приготовления сред не должна содержать посторонних веществ, например щелочей, выделяемых некоторыми сортами стекла. Перед употреблением посуду тщательно мыли, полоскали и высушивали. Среды варили в стеклянных колбах объемом 250 мл. Каждой среды готовили объемом по 100 мл, рассчитанной на 5 культур исследуемых штаммов. После варки среды стерилизовали в автоклаве при 0,5 атм и 120 ○С в течение 20 минут. После стерилизации и добавления соответствующих источников углеродного питания среды разливали в стерильные чашки Петри по 20 мл. Предварительно в чашки вносят по 1 капле молочной кислоты для подкисления среды, которое необходимо, чтобы убить бактерии.
2.7 Определение способности плесневых грибов использовать соединения углерода
Микромицеты характеризуются неодинаковой способностью использовать различные соединения углерода для конструктивного и энергетического метаболизма. Чтобы выяснить возможность роста гриба за счет тех или иных углеродсодержащих веществ, их высевают на синтетические среды, содержащие в качестве единственного источника углерода различные моно-, ди- и полисахариды, многоатомные спирты, органические кислоты, углеводороды.
В качестве единственного источника углерода были выбраны природные растительные материалы: растительный опад, камыш, опилки, кора, сено. Источники углерода добавляли в среду в мелко нарезанном виде. Все источники углерода добавлялись в среды количеством 30 г./л.
В данной работе определение особенностей роста грибов на различных источниках углеродного питания проводилось путем поверхностного посева исследуемых штаммов на среду Чапека с различными источниками углерода. Посев культур осуществляли уколом в центр чашки Петри. Время культивирования составляло 14 суток, температура культивирования – 25 ○С. Значение применяемых питательных сред для процессов роста грибов оценивалось методом измерения радиальной скорости роста путем периодического замера диаметра колоний грибов (через каждые 48 часов), растущих на чашках Петри.
Для определения способности микромицетов использовать различные источники углерода применяют и другие методики.
Например, многие микромицеты могут использовать в качестве единственного источника углерода органические кислоты. Для определения способности расти на средах с органическими кислотами рекомендуется плотная среда состава (г/л): (NH4)2HPO4 – 0,5; MgSO4*7H2O – 0,2; NaCl – 0,1; агар – 15,0; органическая кислота в виде соли Na или К – 2,0; pH 6,8. До стерилизации к среде добавляют 20 мл 0,04% водного раствора индикатора метилрот, который в интервале pH 6,8 – 8,4 изменяет окраску от желтой к красной. Среду разливают в пробирки и стерилизуют при 1 атм. Посев проводят уколом. Продолжительность культивирования от 2 до 14 суток в зависимости от скорости роста микроорганизмов. О потреблении органических кислот свидетельствует рост по уколу и изменение кислотности среды в щелочную сторону, что отчетливо заметно по цвету индикатора.
Некоторые грибы способны использовать и такие химически устойчивые соединения, как углеводороды. Выявить способность микроорганизма окислять жидкие нелетучие углеводороды можно на плотной среде состава (г/л): KNO3 – 4,0; KH2PO4 – 0,6; Na2HPO4*12H2O – 1,4; MgSO4*7H2O – 0,8; выщелоченный агар – 2,0; pH 7,2. Среду стерилизуют в колбах при 1 атм. и разливают в чашки Петри толстым слоем. После того как среда застынет, в центре агаровой пластинки вырезают лунку. Для этой цели можно воспользоваться пробочным сверлом (диаметр 8–10 мм), которое предварительно стерилизуют в пламени горелки. Микромицеты высевают радиальными штрихами от лунки к периферии чашки. В лунку вносят 2–3 капли исследуемого углеводорода (стерилизуют фильтрованием). Чашки помещают в термостат строго горизонтально, не переворачивая. Через 7–10 суток отмечают наличие или отсутствие роста по штриху в сравнении с контролем – ростом на среде без углеводорода (Нетрусов, 2005).
2.8 Определение радиальной скорости роста
Определение радиальной скорости роста грибов проводили на плотной питательной среде за определенный промежуток времени. После 48 часов инкубации при 25 ○С измеряют диаметр выросших на чашках колоний при помощи линейки. Эту операцию повторяют через каждые двое суток в течение двух недель.
За диаметр отдельной колонии в данный момент времени принимают среднее арифметическое измерение. Вычисление радиальной скорости проводят по формуле:
Kr = (r – ro) / (t – to),
где k – радиальная скорость роста;
ro – радиус колоний в начальной момент времени to;
r – радиус колоний в момент времени t (Паников, 1991).
2.9 Обработка полученных данных
В процессе культивирования измеряли диаметр колоний каждые 48 ч и определяли радиальную скорость роста, амплитуду ее изменчивости, характер биоритмов.
На основании полученных данных составляли графики зависимости радиальной скорости роста исследуемых штаммов от времени, определяли способность исследуемых штаммов использовать в качестве единственного источника углерода природные растительные материалы (камыш, сено, растительный опад, опилки, кора).
3. Исследование роста микромицетов на различных источниках углеродного питания
Объектами исследования явились коллекционные штаммы микроскоскопических родов Aspergillus flavus, A. fumigatus, Alternaria sp., Penicillium sp., Cladosporium sp., Trichoderma sp., Verticillium sp. В качестве источника углерода использовали природные растительные материалы: камыш, кору, растительный опад, опилки, сено.
В результате посева исследуемых микроскопических грибов на среду Чапека с различными источниками углерода было установлено, что изменение трофических условий оказывает существенное влияние на развитие микромицетов. Оценка возможности потребления различных источников углерода показала, что они способны утилизировать многие источники углеродного питания, но большинство из исследуемых видов не использовали опилки в качестве единственного источника углерода. Динамика роста видов на разных средах при одинаковых условиях инкубации, не одинакова.
В таблице приложения и на рисунках 1–7 приведены зависимости радиальной скорости роста от времени у изученных грибов на различных источниках углерода.
A. fumigatus развивается на всех источниках углерода с высокой скоростью роста, за исключением среды с опилками, на которой совсем не проявляет признаков роста. До 96 ч. экспозиции радиальная скорость роста на всех средах была примерно одинакова, затем на среде с листьями наблюдается скачок роста (в 4 раза по сравнению с другими средами) в интервале 144 – 192 ч. На остальных средах A. fumigatus растет примерно с одинаковой скоростью, но различались ритмичностью биоритмов. На среде с камышом имеет четкие 2-суточные ритмы. Биоритмы большей продолжительности (4-суточные) отмечены на средах с корой и сеном. Однако на среде с корой A. fumigatus обладает несколько большей скоростью роста. К 288 ч. культивирования скорость радиального роста становятся примерно одинаковой на всех средах.
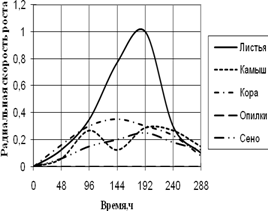
Рис. 1. Радиальная скорость роста A. fumigatus, мм/ч
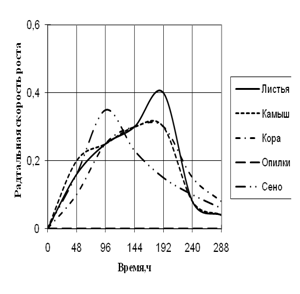
Рис. 2. Радиальная скорость роста A. flavus, мм/ч
Радиальная скорость роста A. flavus на протяжении всей экспозиции значительно не изменялась. Максимальная скорость роста на среде с сеном приходится на 96 ч., на средах с листьями, камышом и корой – на 192 ч. времени культивирования. Также как и A. fumigatus, A. flavus не использует опилки в качестве единственного источника углерода. На средах с листьями и сеном вид растет с 2-суточной периодичностью. Биоритмы большей продолжительности (3,5–4-х суток) наблюдаются на средах с камышом и корой.
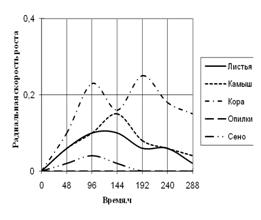
Рис. 3. Радиальная скорость роста Alternaria sp., мм/ч
По данным графика видно, что Alternaria на среде, где в качестве единственного источника углерода присутствует кора, проявляет наибольшую скорость роста с биоритмами 2-ое суток. На среде с сеном Alternaria развивается с очень низкой скоростью и уже к 192 ч. экспозиции прекращает рост. На средах с листьями и камышом растет с одинаковой радиальной скоростью роста до 96 ч. культивирования, затем на среде с камышом происходит скачок примерно в 1,5 раза. На этих средах Alternaria проявляет замедленную ритмичность (более 2-х суток).
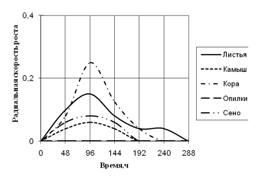
Рис. 4. Радиальная скорость роста Cladosporium sp., мм/ч
Исходя из данных графика 4 видно, что Cladosporium растет на среде с корой с наибольшей скоростью роста и с периодичностью 2-ое суток. К 10-ти суткам культивирования рост на этой среде прекращается. На среде с листьями микромицет растет с меньшей ритмичностью (более 2-суточные биоритмы). С наименьшей радиальной скоростью роста Cladosporium развивается на средах с камышом и сеном с биоритмами четверо суток и прекращает расти к 192 ч. экспозиции. На всех средах рост прекращается еще до 14 дней культивирования.
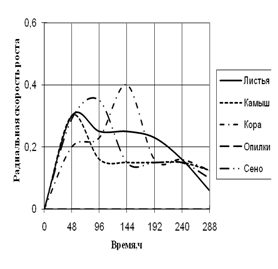
Рис. 5. Радиальная скорость роста Verticillium sp., мм/ч
По данным графика 5 видно, что Verticillium на средах с листьями и камышом в начале культивирования растет с одинаковой скорость роста с 2-суточными биоритмами. С 96 ч. до 192 ч. экспозиции на этих средах происходит задержка роста. На среде с корой микромицет растет с наибольшей скоростью роста с периодичностью в 2-ое суток. Примерно с такой же радиальной скоростью роста Verticillium растет на среде с сеном, но с ритмичностью (более 2-х суток).
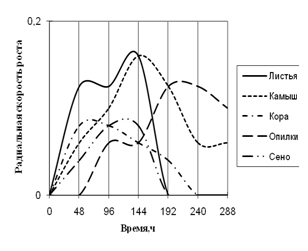
Рис. 6. Радиальная скорость роста Penicillium sp., мм/ч
Из данных графика видно, что Penicillium – единственный из исследуемых штаммов, использующий опилки в качестве единственного источника углерода. Рост начинается с 48 суток культивирования, и развивается на этой среде с более 2-суточной периодичностью. На средах с листьями и камышом микромицет растет с наибольшей радиальной скоростью роста и с 2-суточными биоритмами. К 192 ч. экспозиции на среде с листьями рост прекращается, также как и на среде с сеном. Penicillium с наименьшей скоростью роста растет на средах с корой и сеном с ритмичностью в 2-ое суток.
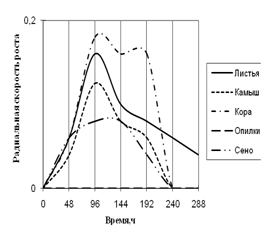
Рис. 7. Радиальная скорость роста Trichoderma sp., мм/ч
Уже на первые сутки культивирования Trichoderma хорошо развивается на всех средах, кроме среды с опилками. На средах с листьями, корой и камышом микромицет растет с 2-суточной периодичностью. С очень низкой скоростью роста и с замедленной ритмичностью (более 2-суточная) Trichoderma растет на среде с сеном. К 240 ч. культивирования рост на всех средах прекращается, за исключением среды с листьями.
Анализируя полученные данные, можно отметить предпочтения исследуемых штаммов к тому или иному источнику углерода. Вид A. fumigatus предпочитает среду с листьями, A. flavus – среды с листьями и сеном, Alternaria, Cladosporium и Trichoderma – среду с корой, Penicillium – среды с листьями, камышом и опилками.
Большинство изученных штаммов обладали 2-суточными биоритмами. Необходимо отметить, что штаммы с наибольшей продолжительностью биоритмов (более чем 2-ое суток) растут с невысокой скоростью роста.
Выводы
1) При определении способности штаммов использовать природные растительные материалы в качестве единственного источника углерода, обнаружено, что наибольшая скорость роста A. fumigatus и A. flavus наблюдается на среде с листьями, Alternaria sp., Cladosporium sp., Verticillium sp. – на среде с корой, Penicillium sp. – на средах с листьями и камышом, Trichoderma sp. – на средах с листьями и корой. Опилки как единственный источник углерода использовал только Penicillium sp. Видимо это объясняется тем, что исследуемые микромицеты были выделены из различных местообитаний.
Список литературы
1) Андреюк, Е.И. Микробная коррозия и ее возбудители [Текст] / Е.И. Андреюк, В.И. Билай, Э.З. Коваль, И.А. Козлова. – Киев: Наук. думка, 1980. – 286 с.; 22 см. – Библиогр.: с. 156. – 200 экз.
2) Бабьева, Е.Н. Сравнительно-экологические исследования микромицетов из почв отдаленных географических районов [Текст] / Е.Н. Бабьева // Микология и фитопатология. Сер. 17. – 1983. – №2. – С. 452–453. Библиогр.: с. 452–453.
3) Бабьева, И.П. Биология почв [Текст] / И.П. Бабьева, Г.М. Зенова. Москва: Изд-во московского ун-та, 1989. – 336 с.; 25 см. Библиогр.: с. 178–179. – 700 экз.
4) Богомолова, Е.В. Морфологические особенности микроколониальных грибов, изолированных с поверхности камня [Текст] / Е.В. Богомолова, М.С. Зеленская, Д.Ю. Власов // Микология и фитопатология. Сер. 35. – 2001. – №3. – С. 6–13. – Библиогр.: с. 17.
5) Билай, В.И. Аспергиллы. Определитель [Текст]: учеб. пособие для вузов / В.И. Билай, Э.З. Коваль: Под ред. В.И. Билай. – Киев: Наукова Думка, 1988. – 203 с.; – Библиогр.: с. 113–117. – 2700 экз.
6) Биоповреждения [Текст] / Под ред. В.Д. Ильичева. – М.: Изд-во Моск. ун-та, 1987. – 352 с.; 24 см. – Библиогр.: с. 207–208. 200 экз. – ISBN 5–02634–675–3.
7) Градова, И.Б. Лабораторный практикум по общей микробиологии [Текст] / И.Б. Градова. – Москва: Дели принт, 2001. – 237 с.; 25 см. Библиогр.: с. 145.
8) Долгова, А.В. Рост колоний Penicillium chrysogenum Thom. при постоянных и переменных температурах [Текст] / А.В. Долгова, В.В. Зданович // Микология и фитопатология. Сер. 31. 1997. – №1. – С. 52–56. – Библиогр.: с. 55.
9) Коваль, Э.З. Микодеструкторы промышленных материалов [Текст] / Э.З. Коваль, Л.П. Сидоренко. – Киев: Наук. думка, 1989. – 192 с.; 22 см. – Библиогр.: с. 135–136. – 300 экз. – ISBN 5–015–02369–7.
10) Лилли, В. Физиология грибов [Текст] / В. Лилли, Г. Барнетт. Москва: Изд-во иностр. литературы, 1957. – 532 с.; 25 см. Библиогр.: с. 152, 174–184. – 2000 экз. – ISBN 5–248–00487–4.
11) Марьиновская, Ю.В. Микробиологическая деструкция целлюлозосодержащих отходов [Текст] / Ю.В. Марьиновская, Н.Н. Севастьянова // Микробиология. – 2006. – №3. – С. 75 – 81. – Библиогр.: с. 78.
12) Методическое пособие: «Идентификация плесневых грибов. Гифомицеты»; сост. Еремеева С.В. – Астрахань, 2007. – 76 с.; – Библиогр.: с. 6. –
13) Мирчинк, Т.Г. Почвенная микология [Текст]: учебник / Т.Г. Мирчинк: М.: Изд-во МГУ, 1988. – 220 с.; 22 см. – Библиогр.: с. 154 -165. – 2940 экз. – ISBN 5–211–00157–5.
14) Мюллер, Э. Микология [Текст] / Э. Мюллер, В. Леффлер; перевод с немецкого канд. биол. наук К.Л. Тарасова. – М.: Мир, 1993. – 535 с.; 25 см. – Библиогр.: с. 90–94. – 2000 экз. – ISBN 5–214–01254–7.
15) Паников, Н.С. Кинетика роста микроорганизмов [Текст] / Н.С. Паников. М.: Наука, 1991. – 309 с.; 22 см. – Библиогр.: с. 245. – 1500 экз. – ISBN 3–271–00356–5.
16) Практикум по микробиологии [Текст] / Под ред. А.И. Нетрусова. М.: Академия, 2005. – 608 с.; 28 см. – Библиогр.: с. 239–240. 5100 экз. – ISBN 5–7695–1809-X.
17) Саттон, Д. Определитель патогенных и условно патогенных грибов: Пер. с англ. [Текст]: учеб. пособие для вузов / О. Саттон, А. Фотергилл, М. Ринальди; под общ. ред. Д.Г. Звягинцев. – М.: Мир, 2001. – 487 с.; 38 см. – Библиогр.: с. 482–486. – 350 экз. – ISBN 5–58974–358–1.
18) Сычугова, О.В. Рост и развитие микромицетов на сополимере этилена и винилацетата с добавками крахмала [Текст] / О.В. Сычугова, Н.Н. Колесникова // Вестн. Моск. ун-та. Сер. 16. Биология. – 2003. – №4. – С. 27–31. Библиогр.: с. 28.
19) Пидопличко, Н.М. Грибная флора грубых кормов [Текст] / Н.М. Пидопличко. Киев: Наук. думка, 1953. – 482 с.; 21 см. – Библиогр.: с. 246. 700 экз.
20) Фомин, В.А. Биоразлагаемые полимеры: состояние и перспективы использования [Текст] / В.А. Фомин, В.В. Гузеев // Пластические массы. – 2001. – №2. – С. 42–46. – Библиогр.: с. 42–43.
21) Шевцова, В.М. Программы развития и возможный принцип их генетического контроля у микромицетов рода Verticillium [Текст] / В.М. Шевцова // Микология и фитопатология. – 1987. – №21. – С. 73–81. – Библиогр.: с. 76.
22) Booth, C. The genus Fusarium [Text] / Commonwealth mycological institute, – Kew. Surrey. – 1971. – P. 237.
23) Caputto, R. The enzymatic transformation of galactose into glucose derivatives [Text] / R. Capputo, L.F. Leloir, R.E. Trucco. – New York: Academic Press, 1949. – P. 497 – 498. Bibliogr.: p. 498.
24) Ellis, M.B. Dematiaceous hyphomycetes. Commonwealth. Kew [Text] / M.B. Ellis. – New York: Academic Press, 1971. – 608 p.; 25 cm. – Bib.: p. 246. – 3000 copy.
25) Klich, M. A laboratoty quide to common Aspergillus species and their telemorphs [Text]. New South Wales. Australia. Commenwealth Scientific and industrial research organization, 1992. P. 116.
26) Margolin, A.S. The effect of various carbohydrates upon the growth of some fungi. [Text] / A.S. Margolin. West Virginia University, 1942.
27) Nord, F.F. Resent progress in the biochemistry of Fusaria [Text] / F.F. Nord, R.P. Mull. New York: Advances in Enzymol., 1945. – P. 165 – 205.
© 2010 Интернет База Рефератов