
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Контрольная работа: Основы ветеринарной вирусологии
Контрольная работа: Основы ветеринарной вирусологии
Министерство сельского хозяйства РФ
ФГОУ ВПО "Вологодская государственная молочнохозяйственная академия имени Н.В. Верещагина"
Факультет ветеринарной медицины (заочное отделение)
Специальность 111201.65 "Ветеринария"
Кафедра эпизоотологии и микробиологии
Контрольная работа по дисциплине
"Ветеринарная вирусология"
Выполнил
студент 0932012
Ронина Ольга Александровна
гр. 2/1
Проверил
Закрепина Елена Николаевна
Вологда Молочное
2010 г.
Содержание
1. Специфические факторы противовирусного иммунитета
2. Вирус инфекционного бронхита птиц
3. Вирус ящура
4. Культивирование вирусов в культуре клеток
1. Специфические факторы противовирусного иммунитета
Специфическая система иммунитета имеет свои центральные (костный мозг, тимус, фабрициева сумка у птиц, печень у млекопитающих) и периферические органы (селезенка, лимфатические узлы, лимфоидные ткани желудочно-кишечного тракта, а также кровь и лимфа, в которые поступают и непрерывно в них циркулируют все иммунокомпетентные клетки).
Органом иммунитета является лимфоидная ткань, а его основными исполнителями — макрофаги (а также другие антиген-представляющие клетки), различные популяции и субпопуляции Т- и В-лимфоцитов.
Основной мишенью действия иммунной системы являются антигены, подавляющее большинство которых имеет белковую природу. Лимфоциты представлены двумя большими популяциями — В- и Т-клетками, которые ответственны за специфическое распознавание антигенов. Возникнув из общей исходной, так называемой стволовой клетки, и пройдя соответствующую дифференцировку в центральных органах иммунной системы, Т- и В-лимфоциты приобретают иммунокомпетентность, выходят в кровь и непрерывно циркулируют по организму, выполняя роль его эффективных защитников.
Т-лимфоциты обеспечивают клеточный тип иммунных реакций, а В-лимфоциты — гуморальный тип иммунного ответа.
Дифференцировка предшественников Т-лимфоцитов в иммунокомпетентные клетки ("обучение") происходит в тимусе под влиянием гуморальных факторов, секретируемых тимусом; созревание В-лимфоцитов — у птиц в бурсе, у млекопитающих сначала в печени плода, а после рождения в костном мозге.
Зрелые В- и Т-лимфоциты приобретают способность распознавать чужеродные антигены. Они покидают костный мозг и тимус и заселяют селезенку, лимфатические узлы и другие скопления лимфатических клеток. Подавляющее большинство Т- и В-лимфоцитов циркулирует в крови и лимфе. Такая постоянная циркуляция обеспечивает контакт как можно большего числа соответствующих лимфоцитов с антигеном (вирусом).
Каждая В-клетка генетически запрограммирована на синтез антител к одному определенному антигену. Встретив и распознав этот антиген, В-клетки размножаются и дифференцируются в активные плазматические клетки, секретирующие антитела на данный антиген. Другая часть В-лимфоцитов, пройдя 2—3 цикла деления, превращается в клетки памяти, которые не способны к выработке антител. Они могут жить много месяцев и даже лет безе деления, циркулируя между кровью и вторичными лимфоидными органами. Быстро распознают антиген при повторном его поступлении в организм, после чего клетки памяти приобретают способность к делению и превращаются в плазматические клетки — секретирующие антитела.
Таким же образом образуются клетки памяти из Т-лимфоцитов. Это можно назвать "резервом" иммунокомпетентных клеток.
Клетки памяти определяют продолжительность приобретенного иммунитета. При повторном контакте с данным антигеном они быстро превращаются в клетки-эффекторы. При этом В-клетки памяти обеспечивают синтез антител в более короткий срок, в большем количестве и в основном IgG. Установлено, что существуют Т-хелперы, которые определяют переключение классов иммуноглобулинов.
Различают два варианта выдачи иммунного ответа в форме биосинтеза антител
-первичный ответ — после первой встречи организма с антигеном;
-вторичный ответ —при повторном контакте с антигеном, через 2—3 нед.
Они различаются по следующим показателям: продолжительностью латентного периода; скоростью нарастания титра антител, общего количества синтезируемых антител; последовательностью синтеза иммуноглобулинов различных классов. Клеточные механизмы первичного и вторичного иммунных ответов также отличаются.
При первичном иммунном ответе отмечают:
-биосинтез антител после латентного периода продолжается 3— 5 Дней;
-скорость синтеза антител относительно невелика;
-титр антител не достигает максимальных значений;
-первыми синтезируются IgM, затем IgG и позже IgA и IgE.
Вторичный иммунный ответ характеризуется:
-латентный период — в пределах нескольких часов;
-скорость синтеза антител имеет логарифмический характер;
-титр антител достигает максимальных значений;
-синтезируется сразу IgG.
Вторичный иммунный ответ обусловлен клетками иммунной памяти.
Т-клетки имеют несколько популяций с различными функциями. Одни взаимодействуют с В-клетками, помогая им размножаться, созревать и образовывать антитела, а также активируют макрофаги — хелперные Т-клетки (Тх); другие угнетают иммунные реакции — супрессорные Т-клетки (Тс); третья популяция Т-клеток осуществляет разрушение клеток организма, зараженных вирусами или иными агентами. Этот тип активности назван цитотоксичностью, а сами клетки — цитотоксическими Т-клетками (Тц) или Т-киллерами (Тк).
Поскольку Т-хелперы и Т-супрессоры действуют как регуляторы иммунного ответа, эти два типа Т-лимфоцитов называют Т-клетками-регуляторами.
Существенным фактором в противовирусном иммунитете являются макрофаги. Они не просто уничтожают чужеродные антигены, но и предоставляют антигенные детерминанты для запуска цепи иммунных реакций (презентируют). Поглощенные макрофагами антигены расщепляются на короткие фрагменты (антигенные детерминанты), которые связываются с молекулами белков главного комплекса гистосовместимости (ГКГС I, II) и транспортируются на поверхность макрофагов, где они распознаются Т-лимфоцитами (Тх, Тк) и В-лимфоцитами, что приводит к их активации и размножению.
Т-хелперы, активируясь, синтезируют факторы (медиаторы) для стимуляции В- и Т-лимфоцитов. Активированные Т-киллеры размножаются и образуется пул цитотоксических Т-лимфоцитов, способных обеспечить гибель клеток-мишеней, т. е. клеток, зараженных вирусом. Активированные В-лимфоциты размножаются и дифференцируются в плазматические клетки, которые синтезируют и секретируют антитела соответствующего класса (IgM, IgG, IgA, IgD, IgE).
Координированное взаимодействие макрофагов, Т- и В-лимфоцитов при встрече с антигеном обеспечивает как гуморальный, так и клеточный иммунный ответ. Для всех форм иммунного ответа требуется согласованное взаимодействие основных факторов иммунной системы: макрофагов, Т-, В-лим-фоцитов, NK-клеток, системы интерферонов, комплемента, главной системы гистосовместимости. Взаимодействие между ними осуществляется с помощью разнообразных синтезируемых и секретируемых медиаторов.
Медиаторы, вырабатываемые клетками иммунной системы и участвующие в регуляции ее активности, получили общее название цитокинов (от греч. cytos — клетка и kineo — приводить в движение). Их подразделяют на монокиы медиаторы, продуцируемые моноцитами и макрофагами; лимфокины — медиаторы, секретируемые активированными лимфоцитами; лимфокины, которые химически идентифицированы и получены в чистом виде. В 1979 г. было предложено назвать их интерлейкинами. Они обозначаются номерами — 1, 2, 3, 4, 5 и т. д. Семейство интерлейкинов пополняется новыми представителями, которые осуществляют взаиморегуляцию иммунной, нервной и эндокринной систем. Все иммунокомпетентные клетки на своих мембранах несут уникальные рецепторы, с помощью которых они распознают и воспринимают сигналы от других иммунных клеток, перестраивают свой метаболизм, синтезируют или устраняют свои собственные рецепторы. Благодаря этому все клетки иммунной системы функционируют как хорошо отлаженная система.
Основные особенности противовирусного иммунитета. Особенности проявления иммунного ответа при вирусных заболеваниях определяются тем, что вирусы являются облигатными внутриклеточными паразитами со своеобразным способом размножения. Главным свойством всех клеток-киллеров является то, что под их влиянием клетке-мишени запускаются механизмы апоптоза (запрограммированной гибели клетки). Лизис клетки происходит после отсоединения киллера, что позволяет одному киллеру лизировать несколько клеток-мишеней. В процессе лизиса участвуют секретируемые лимфоцитами перфорины и гранзимы. Перфорин, встраиваясь в мембрану клетки, формирует в ней канал, через который в клетку проникает вода. Клетка разбухает и лизируется. Считают, что гранзимы обусловливают индукцию апоптоза.
![]()
![]()
![]() Ранняя стадия инфекции, как правило,
состоит в противоборстве вируса с защитными системами организма-хозяина. Самый
первый защитный барьер — кожные покровы и слизистые оболочки организма. В
случае нарушения их целостности в действие вступают механизмы экстренной
неспецифической защиты (факторы врожденного иммунитета). Среди них особо
выделяют противовирусную активность интерферона, ЕК-клетки (естественные
киллеры) и макрофаги.
Ранняя стадия инфекции, как правило,
состоит в противоборстве вируса с защитными системами организма-хозяина. Самый
первый защитный барьер — кожные покровы и слизистые оболочки организма. В
случае нарушения их целостности в действие вступают механизмы экстренной
неспецифической защиты (факторы врожденного иммунитета). Среди них особо
выделяют противовирусную активность интерферона, ЕК-клетки (естественные
киллеры) и макрофаги.
![]() Противовирусное действие интерферона.
Инфицирование клетки
вирусом вызывает синтез интерферона. Под его действием активируются защитные
механизмы соседних клеток, обеспечивая их устойчивость к вирусной инфекции.
Интерферон индуцирует синтез двух ферментов: протеинкеназы, что ведет к
подавлению синтеза вирусных белков, и 2', 5'-олигоаденилатсинтетазы,
активирующей эндонуклеазу, которая разрушает вирусную и-РНК. Кроме того, интерферон
сильно активирует макрофаги и ЕК-клетки.
Противовирусное действие интерферона.
Инфицирование клетки
вирусом вызывает синтез интерферона. Под его действием активируются защитные
механизмы соседних клеток, обеспечивая их устойчивость к вирусной инфекции.
Интерферон индуцирует синтез двух ферментов: протеинкеназы, что ведет к
подавлению синтеза вирусных белков, и 2', 5'-олигоаденилатсинтетазы,
активирующей эндонуклеазу, которая разрушает вирусную и-РНК. Кроме того, интерферон
сильно активирует макрофаги и ЕК-клетки.
Противовирусное действие ЕК-клеток и макрофагов. Активные ЕК-клетки появляются уже через двое суток после заражения организма-хозяина вирусом. ЕК-клетки и макрофаги уничтожают зараженные клетки. Главным образом ЕК-клетки осуществляют реакцию антителозависимой клеточной цитотоксичности (АЗКЦ).
Если вирусу удается преодолеть барьеры врожденной защиты, он вызывает развитие специфического иммунного ответа с появлением Т-киллеров, Т-хелперов и противовирусных антител. Главную роль в иммунном ответе отводят антителам и Т-киллерам. Основные механизмы противовирусного иммунитета сводятся к блокаде распространения вирусных частиц и уничтожению зараженных вирусом клеток, т. е. клеток, которые фактически являются "фабриками" по производству новых вирусов.
Роль антител.
Распространение вируса в организме блокируют в основном антитела. В процессе развития специфического иммунитета синтезируются антитела к большинству антигенов вируса. Однако считается, что вирусную инфекцию сдерживают в основном антитела к поверхностным гликопротеинам. Эти антигены, часто называемые протективными, локализованы на поверхности вирионов или экспрессируются на мембране зараженной вирусом клетки. Механизмы гуморального противовирусного иммунитета могут быть различными. Способ устранения инфекционности вирусных частиц зависит от их локализации — внеклеточной или внутриклеточной.
Антитела, адсорбируясь на поверхности вирионов, блокируют его жизненно важные функции. Прежде всего, это блокада прикрепления к клетке хозяина, проникновения в нее, раздевание вируса. Адсорбция антител на белках капсида не позволяет некоторым вирусам (вирусу чумы плотоядных, кори и др.) проникать из клетки в клетку путем их слияния. Кроме того, считают, что антитела, активируя систему комплемента, вызывают повреждения оболочки некоторых вирусов и блокируют клеточные рецепторы для вирусов. Однако в настоящее время этот процесс не считают существенным в противовирусной защите.
Действие антител, помимо нейтрализации внеклеточных вирусов, состоит в том, что они вызывают разрушение инфицированных вирусами клеток, активируя систему комплемента. Второй механизм действия антител на внутриклеточный вирус — это реакция антителозависимой клеточной цитотоксичности, осуществляемая ЕК-клетками. Антитела, фиксированные на мембране пораженной вирусом клетки, контактируют с ЕК-клетками (через Fc-фрагмент IgG), которые убивают зараженные клетки с помощью перфоринов и гранзимов.
Роль Т-клеток.
В иммунитете к вирусным инфекциям Т-клетки выполняют разнообразные функции. Т-хелперы играют важную роль в образовании антител в ответ на антигены, кроме того, эти клетки помогают в индукции Т-киллеров, а также в привлечении макрофагов и Е-клеток в очаг вирусной инфекции и в их активации. Т-киллеры осуществляют противовирусный иммунологический надзор, и действуют они весьма эффективно и избирательно, разрушая инфицированные вирусами клетки с помощью перфоринов и гранзимов. Проникнув внутрь клетки-мишени, гранзимы через каскад реакций активируют эндонуклеазы. Этот фермент способствует разрыву цепей ДНК и развитию апоптоза (программированная гибель клеток).
Механизмы "ухода" вирусов от иммунного надзора организма хозяина. Вирусы обладают разнообразными свойствами защиты от распознавания их антителами:
наиболее эффективно этому служит смена антигенов: в вирусных белках происходит изменение иммунодоминатных областей. Антигенная изменчивость наблюдается у вирусов иммунодефицита человека и у вирусов гриппа. Так, у вируса гриппа она называется антигенным "дрейфом" (постепенные изменения) и "шифтом" (резкие изменения). Гуморальный иммунитет к этим вирусным инфекциям сохраняется лишь до появления нового сероварианта возбудителя, что не позволяет рассчитывать на долговременный эффект вакцинации;
антитела могут удалять вирусные антигены с плазматической мембраны клетки путем кеппинга (агрегации молекул клеточной поверхности). Так, герпесвирусы кодируют гликопротеины, связывающие антитела через Fc-фрагмент, при этом нарушается активация комплемента и блокируется действие противовирусных антител;
![]() ряд вирусов (цитомегало-, аденовирусы
и др.) индуцируют выработку белков, подавляющих экспрессию молекул ГКГС класса на
мембране пораженных клеток. Это дает вирусу преимущество, помогая избежать
распознавание эти отдельные вирусы (герпесвирусы) обладают генами белков,
гомологичных цитокиновым рецепторам. В результате эти "растворимые"
рецепторы как "ловушки" связывают цитокины и нейтрализуют их
действия;
ряд вирусов (цитомегало-, аденовирусы
и др.) индуцируют выработку белков, подавляющих экспрессию молекул ГКГС класса на
мембране пораженных клеток. Это дает вирусу преимущество, помогая избежать
распознавание эти отдельные вирусы (герпесвирусы) обладают генами белков,
гомологичных цитокиновым рецепторам. В результате эти "растворимые"
рецепторы как "ловушки" связывают цитокины и нейтрализуют их
действия;
некоторые вирусы (вирус Эпштейна — Барра, аденовирусы) способны противодействовать эффекту интерферонов — они продуцируют короткие отрезки РНК, которые каким-то образом подавляют активацию протеинкиназы;
многие вирусы способны вызывать у макрофагов выработку супрессирующих цитокинов, подавляющих развитие иммунного ответа.
![]() 2. Вирус инфекционного бронхита птиц
2. Вирус инфекционного бронхита птиц
Инфекционный бронхит (ИБ) — высококонтагиозная болезнь проявляющаяся у цыплят респираторным и уремическим синдромом, а у кур — поражением герминативных органов и снижением яйценоскости.
Заболевание распространено во всех странах с развитым промышленным птицеводством. Наносит огромный экономический ущерб, заключающийся в снижении мясной и яичной продуктивности на 50—60 %, гибели цыплят первого месяца жизни до 30 %, выбраковке до 60 % птицы при хроническом течении болезни с осложнениями бактериальными инфекциями.
В естественных условиях восприимчивы куры всех возрастных групп; наиболее подвержены заболеванию цыплята до 30-дневного возраста. Человек переболевает с легкими признаками поражения верхних дыхательных путей.
Характеристика возбудителя.
Возбудитель ИБ — РНК-содержащий вирус, относящийся к семейству Coronaviridae. Вирионы его изометрической формы, размером 70—120 нм, заключены в суперкапсидную оболочку с редкими булавовидными выступами, напоминающими солнечную корону.
Все штаммы вируса ИБ очень чувствительны к УФ-облучению, в течение трех минут обезвреживаются 1%-ными растворами фенола, крезола, формалина, 70%-ным раствором этилового спирта. В аллантоисной жидкости при минус 25 °С сохраняют активность до 537 дней.
Антигенная вариабельность.
Вирусу присуща значительная антигенная вариабельность. Определены 7 серотипов. Выделенные в нашей стране штаммы относятся к серотипам Массачусетс и Коннектикут. Выделение полевых изолятов, отличающихся по антигенному составу от этих серотипов, вынуждает вести работу по созданию новой вакцины.
Антигенная структура. Белки вируса различаются по тканевому тропизму. Патогенность штаммов вируса связана с изоэлектрическими точками их белков. Классификация белков на основе изоэлектрических точек позволяет идентифицировать высокопатогенные и персистентные штаммы. На поверхности вируса обнаружено пять агглютининов: А, В, С, D, Е, из которых первые четыре ответственны за нейтрализацию вируса. Из 16 моноклональных антител все реагировали с белками пепомеров, а один тип антител нейтрализовал инфекционность и подавлял гемагглютинирующую активность вируса.
Антигенная активность.
Переболевание птицы сопровождается образованием антигемагглютинирующих, вируснейтрализующих антител и практически пожизненным иммунитетом к гомологичному типу вируса. У кур-реконвалисцентов вируснейтрализующие антитела обнаруживались 482 дня. Преципитирующие антитела появлялись в сыворотке крови через 2—3 нед, но исчезали раньше, чем вируснейтрализующие антитела. В крови кур-реконвалисцентов найдены комплементсвязывающие антитела.
Культивирование вируса. Вирус удается культивировать на куриных эмбрионах при заражении в аллантоисную полость, амнион или на ХАО. Признаки размножения вируса в курином эмбрионе — "эффект карликовости" (замедление роста), мумификация, шарообразная форма зародыша и гибель на 3—6-й день после заражения. Значительное количество штаммов вируса размножается в культуре клеток куриного эмбриона и ВНК-21 с образованием ЦПД.
Гемагглютинирующая активность.
У большинства штаммов вируса И Б она не наблюдается. Штамм Коннектикут способен агглютинировать эритроциты кур, штамм же Массачусетс проявляет такую активность только после обработки трипсином или фосфолипазой С.
Клинические признаки.
Отмечают три клинических синдрома болезни: респираторный, нефрозо-нефритный и репродуктивный.
Респираторный синдром проявляется чаще у цыплят до 1-месячного возраста и характеризуется кашлем, трахеальными хрипами, носовыми истечениями, затрудненным дыханием, конъюнктивитом, синуситом и высокой летальностью. У цыплят 1—2-месячного возраста болезнь протекает хронически с колибактериозом и микоплазмозом.
Нефрозо-нефритный синдром наблюдают у цыплят до 2-недельного возраста при заражении их нефротропными штаммами вируса. Появляется диарея, гибнет до 70 % цыплят.
Репродуктивный синдром регистрируют обычно у кур старше бмес; характеризуется резким снижением яйценоскости, неправильной формой скорлупы яиц. У 20—25 % кур-несушек, переболевших ИБ в раннем возрасте, отмечают недоразвитость яйцевых фолликул.
Патологоанатомические изменения.
При вскрытии обнаруживают серозный катаральный и казеозный экссудат в трахее и бронхах (при респираторном синдроме) поражение почек и мочеточников (при нефрозо-нефритном синдроме), недоразвитость яйцевых фолликулов (при репродуктивном синдроме).
![]()
![]()
![]() Локализация вируса.
Локализация вируса.
В первые две недели болезни вирус адсорбируется на клетках слизистых оболочек респираторного тракта и размножается в них. Развитие инфекционного процесса сопровождается виремией с локализацией вируса в лейкоцитах и эритроцитах в течение нескольких недель после заражения. С кровью вирус попадает в почки, легкие, яичники и яйцеводы, в клетках которых размножается и вызывает патологический процесс. УдАется обнаружить его также в селезенке (до 49 дней), в почках (до 35 дней), в клоаке (до 45 дней).
Выделяется вирус с истечениями из глаз и носа, а также с фекалиями, у петухов — со спермой в течение 20 дней после заражения. С содержимым яиц от больных кур вирус выделяется до 6 недель после их заражения.
Источник инфекции.
Основной источник инфекции — больные и переболевшие цыплята и куры. Выздоровевшие птицы остаются вирусоносителями, а хозяйство ряд лет считается неблагополучным по заболеванию. Вирус передается аэрогенно, алиментарно, прямым и непрямым контактом, а также трансовариально.
Диагностика.
Диагноз ставят на основании эпизоотологических данных, клинических признаков болезни, патологоанатомических изменений и лабораторных исследований.
Лабораторная диагностика. Патологическим материалом для лабораторных исследований служат смывы с гортани, трахеи от больных птиц и соскобы от трупов, кусочки легких, почек, а от взрослой птицы почки и яйцеводы.
![]() Обнаружение вирусной нуклеиновой
кислоты в патологическом материале проводят с помощью ПЦР. Антиген вируса можно
быстро обнаружить в РДП и РИФ. Использование в РИФ группоспецифических
моноклональных антител или гипериммунной сыворотки позволяет сразу же провести
серотипизацию.
Обнаружение вирусной нуклеиновой
кислоты в патологическом материале проводят с помощью ПЦР. Антиген вируса можно
быстро обнаружить в РДП и РИФ. Использование в РИФ группоспецифических
моноклональных антител или гипериммунной сыворотки позволяет сразу же провести
серотипизацию.
Активный вирус ИБ обнаруживают биопробой. Наиболее результативно проведение ее на цыплятах 10—25-дневного возраста из хозяйств, благополучных по респираторным болезням. Суспензией, полученной из патологического материала, заражают цыплят интратрахеально и через 1—5 дней наблюдают появление респираторных симптомов и патологоанатомических изменений, характерных для ИБ.
Для постановки биопробы на 8—10-дневных куриных эмбрионах необходимо провести 6—8 "слепых" пассажей. В процессе пассирования полевой изолят вируса адаптируется к куриным эмбрионам, и на них начинают проявляться типичные для ИБ патологические изменения. Культуру клеток для биопробы не используют, так как в ней вирус может вызвать ЦДП только после адаптации к куриным эмбрионам.
Идентификация. Материал, полученный в результате биопробы, содержит вирус, который необходимо идентифицировать в РДП, РНГА и РИФ, а типовую принадлежность определяют в РН на куриных эмбрионах и в РТГА.
Быстрее поставить диагноз позволяют серологические исследования.
Серодиагностика основана на выявлении у больных и переболевших птиц антител в РН, РНГА и ИФА. Причем если рН определяет накопление антител в организме в период с 10-го по 36-й день болезни, то РНГА — со 2-го по 14-й день, ИФА — с 3-го дня.
Установлено, что серологические данные не позволяют судить о резистентности конкретного поголовья птиц к заражению вирусом И Б, так как не всегда уровень антител коррелирует с резистентностью. В последнем случае важную роль играет местный тканевый иммунитет респираторного трахеита.
Дифференциальная диагностика.
Следует учитывать, что ИБ сходен с инфекционным ларинготрахеитом, ньюкаслской болезнью и гриппом птиц. Дифференциальную диагностику этих заболеваний проводят лабораторными методами.
Иммунитет и специфическая профилактика.
Переболевшая птица резистентна к заражению гомологичным штаммом вируса в течение 5—6 мес. Трудность обеспечения специфической профилактики инфекционного бронхита кур обусловлена большой антигенной и иммунологической вариабельностью полевых штаммов вируса.
Для профилактики инфекции применяют как живые, так и инактивированные вакцины. Материнские антитела от иммунных кур-несушек передаются через яйцо цыплятам и защищают их в первые 2—4 нед жизни. Наиболее выраженный иммунный ответ получен при вакцинации в 3—4-недельном возрасте живой вакциной, а в 16-недельном — инактивированной. Учитывая факт образования местного тканевого иммунитета в респираторном тракте, живые вакцины применяют орально (с питьевой водой) или путем закапывания в нос.
3. Вирус ящура
Ящур остропротекающая высококонтагиозная болезнь парнокопытных, проявляющаяся лихорадкой, везикулярным поражением слизистых оболочек рта, кожи венчика и вымени, у молодых животных — поражением миокарда и скелетных мышц. Ящур регистрируется во многих странах мира.
В естественных условиях к вирусу ящура восприимчивы домашние и дикие парнокопытные. Могут заражаться и бессимптомно переболевать собаки и кошки. Человек заражается редко при употреблении необеззараженного молока от больных животных.
Характеристика возбудителя.
РНК-содержащий вирус относится к семейству Picornaviridae, роду Aphtovirus. Геном представлен единой односпиральной линейной плюс-РНК. Вирионы вируса представляют собой лишенные суперпапсидной оболочки частицы кубической симметрии диаметром 22—30 нм.
Устойчивость к физико-химическим воздействиям. Вирус ящура устойчив к эфиру, хлороформу, фреону. Быстро инактивируется в среде с рН 6,0 и ниже. Наиболее стабилен при рН 7,0—7,5. Хлорная известь, креолин, крезол, фенол убивают вирус лишь через несколько часов. Растворы щелочей (2%-ные) инактивируют его за 10 мин. Вирус устойчив к влиянию факторов внешней среды; афтозная лимфа, содержащая вирус, инактивируется при температуре 31 °С за 24 ч, в молоке при температуре от 66 до 78 °С вирус погибает через 1 мин. Низкие температуры его консервируют: при минус 40 — минус 70 °С сохраняет биологические свойства несколько лет. В сточных водах вирус выживает до ЮЗ дней. Хороший консервант — 50%-ный раствор глицерина на фосфатном буфере, в нем при 4—8 °С вирус сохраняется в течение 40 дней. Лучшие дезинфицирующие средства — 2- или 3%-ные горячие растворы гидрокарбоната натрия и 1%-ный раствор формальдегида.
Антигенная структура.
Основные структурные белки вируса ящурА _ vpi, VP2, VP3 и VP4. Белок VP1 расположен поверхностно и обусловливает индукцию вируснейтрализующих антител, которые защищают животное от вирулентного вируса.
В вируссодержащей
суспензии присутствуют инфекционные инеинфекционные вирусные частицы: 140S —полные вирионы;![]() 5S
капсиды без РНК; 12S—14S — белковые субъединицы и Via-чтиген, который находится в
инфицированных клетках, но не является составной частью вириона. Все названные
компонентк обладают антигенными свойствами, но иммуногенными являются лишь 140S- и 755-частицы. Инфекционностью
обладают только HOS-частицы
(полные вирионы).
5S
капсиды без РНК; 12S—14S — белковые субъединицы и Via-чтиген, который находится в
инфицированных клетках, но не является составной частью вириона. Все названные
компонентк обладают антигенными свойствами, но иммуногенными являются лишь 140S- и 755-частицы. Инфекционностью
обладают только HOS-частицы
(полные вирионы).
Антигенная вариабельность.
В настоящее время известны 7 антигенных типов вируса ящура: А, О, С, Сат-1, Сат-2, Сат-3 и Азия-1. Внутри основных типов существуют варианты, или подтипы, отличающиеся друг от друга. Тип А имеет 32 варианта, тип О — 11 вариантов, тип С —5, тип Сат-1 —7 вариантов, тип Сат-2 з варианта, тип Сат-3 — 4 варианта и тип Азия-1 — 2 варианта. Антигенные типы и варианты, установленные в РСК, различаются и иммунологически. Переболевшие животные приобретают выраженный иммунитет к гомологичному вирусу. Следовательно, для специфической профилактики ящура на каждый тип вируса должна быть вакцина.
Антигенная активность.
В организме естественно восприимчивых животных вирус индуцирует образование вируснейтрализующих, комплементсвязывающих и преципитирующих антител.
Культивирование вируса.
Вирус культивируется на естественно восприимчивых и лабораторных животных: новорожденных мышатах и крольчатах, хомяках 60-дневного возраста, взрослых морских свинках. Хорошо размножается в культуре клеток почек восприимчивых животных, в культуре эксплантантов эпителия языка крупного рогатого скота и в некоторых перевиваемых линиях клеток (ВНК-21, СПЭВ и др.) с выраженным цитопатическим действием.
Экспериментальная инфекция. Легко воспроизводится путем аппликации вируссодержащего материала в скарифицированную поверхность слизистой языка, десен крупного рогатого скота, овец и свиней (в пятачок), а также при подкожной инокуляции вируса новорожденным мышатам или крольчатам и внутрикож-ном введении материала в плантарную поверхность задних лапок морских свинок.
Гемагглютинирующие свойства.
Вирус ими не обладает.
Клинические признаки.
Инкубационный период длится 1—3 дня, иногда до 7—10 дней. Самый характерный признак данного заболевания у животных — везикулярное поражение слизистых рта, кожи венчика и вымени. У крупного рогатого скота и свиней ящур протекает остро, у взрослых животных, как правило, доброкачественно. Заболевание очень быстро распространяется. Вначале отмечают ухудшение аппетита, повышенную саливацию, повышение температуры тела (до 40,5—41,5 °С). На 2—3-й день на внутренней поверхности губ и на языке появляются афты. У некоторых животных афты образуются на вымени. Заболевание конечностей сопровождается хромотой. Через сутки афты разрываются и образуются эрозии. Через 2—3 нед эрозии заживают и животные выздоравливают. У свиней, овец и коз поражение наблюдают чаще на конечностях и реже на слизистых оболочках рта. Довольно часто поражается вымя. У молодняка ящур обычно протекает злокачественно (гибель — 80 % и более), афт, как правило, нет.
Патологоанатомические изменения.
При вскрытии павших молодых животных отмечают геморрагическое воспаление кишечника и дегенеративные изменения в мышцах сердца ("тигровое" сердце), подобные изменения находят в скелетных мышцах.
Локализация вируса. От больных живот- ных вирус можно выявить уже в инкубационный период из молока, спермы, слюны (за 4—7 дней до клинических признаков). Наибольшее количество вируса содержится в эпителии и жидкости везикул (до 108ИД/г). Экскреты и секреты больных животных инфекционны более 10 дней. Выделяется вирус и с выдыхаемым воздухом. Переболевание может сопровождаться длительным вирусоносительством. Около 50 % крупного рогатого скота может выделять вирус в течение 8 мес, а некоторые — до двух лет. У свиней персистентного носительства вируса не установлено. В стадах буйволов инфекцию в течение многих лет поддерживают вирусоносители и животные со скрытым течением инфекции.
Источником инфекции служат больные животные и вирусоносители. Весьма существенна эпизоотологическая роль диких парнокопытных. Вирус очень контагиозен, поэтому болезнь быстро распространяется среди восприимчивых животных. В распространении ящура серьезную роль играют продукты и сырье животного происхождения, а также предметы ухода, навоз и корма, загрязненные выделениями больного скота. Переносчиками инфекции могут быть и невосприимчивые к ящуру животные (собаки, кошки, лошади и птицы).
Диагностика.
Диагноз на ящур ставят на основании эпизоотологических данных (высокая контагиозность и избирательное поражение только парнокопытных), клинических признаков (везикулярное поражение слизистых оболочек рта, кожи, конечностей и вымени), патологоанатомических изменений (при гибели молодняка — поражение кишечника и мышц сердца) и результатов лабораторных исследований.
Диагностировать ящур по клиническим признакам довольно легко, но для врача хозяйства важно знать, каким типом вируса ВЫЗВАНО заболевание, чтобы применять соответствующую вакцину. Тип вируса определяют в лаборатории.
![]()
![]()
![]() Взятие и подготовка материала. Для лабораторных исследований от 2—3
больных животных отбирают не менее 5 г стенки и содержимого афт на слизистой
оболочке языка (у крупного рогатого скота), на пятачке (у свиней), на коже
венчика и межпальцевой щели (у крупного и мелкого рогатого скота, свиней,
верблюдов и др.). При отсутствии афт берут кровь животных в момент
температурной реакции, из трупов молодняка животных всех видов — лимфатические
узлы головы и заглоточного кольца поджелудочную железу и мышцу сердца. Для
исследования на вирусоносительство берут пищеводно-глоточную слизь (специальным
зондом).
Взятие и подготовка материала. Для лабораторных исследований от 2—3
больных животных отбирают не менее 5 г стенки и содержимого афт на слизистой
оболочке языка (у крупного рогатого скота), на пятачке (у свиней), на коже
венчика и межпальцевой щели (у крупного и мелкого рогатого скота, свиней,
верблюдов и др.). При отсутствии афт берут кровь животных в момент
температурной реакции, из трупов молодняка животных всех видов — лимфатические
узлы головы и заглоточного кольца поджелудочную железу и мышцу сердца. Для
исследования на вирусоносительство берут пищеводно-глоточную слизь (специальным
зондом).
![]()
![]() Материал необходимо получать так, чтобы предупредить
вынос вируса за пределы неблагополучного очага и лаборатории, обезопасить
персонал, работающий с инфекционным материалом.
Материал необходимо получать так, чтобы предупредить
вынос вируса за пределы неблагополучного очага и лаборатории, обезопасить
персонал, работающий с инфекционным материалом.
Для этого:
а) ветврач хозяйства должен иметь определенные навыки взятия материала от больных животных;
б) необходимо подготовить все для отбора материала — пинцеты, ножницы, салфетки, толстостенные флаконы, лейкопластырь, резиновые пробки, 50%-ный раствор стерильного глицерина на изотоническом растворе хлорида натрия, термос с охлаждающей смесью, дезра-створ — 2%-ный раствор NaOH или 1 %-ный раствор уксусной или молочной кислоты; спецодежду — халаты, комбинезоны, косынки или шапочки, маски, резиновые сапоги, перчатки и т. д. Все необходимое помещают в контейнер и едут в неблагополучный очаг, где, прежде чем войти в помещение с больными животными, переодеваются; в) после взятия материала от больных животных инструменты, маску, перчатки погружают в дезраствор; наружную поверхность флаконов и термоса обрабатывают дезраствором. В санпропускнике снимают всю одежду и принимают душ.
В носовой полости у людей вирус ящура переживает до 7 дней, следовательно, в течение этого времени после посещения неблагополучного хозяйства нежелателен контакт со здоровыми парнокопытными животными.
Пробы материала без признаков разложения помещают во флаконы с завинчивающимися или притертыми пробками и замораживают, а при отсутствии условий замораживания заливают консервирующей жидкостью (50%-ным стерильным раствором глицерина на изотоническом растворе NaCI). На флаконы наклеивают этикетки с указанием вида животных, наименования материала, его количества, даты отбора и адреса отправителя. Флаконы ставят в непроницаемый металлический контейнер, опечатывают и помещают в термос со льдом, который тоже опечатывают. К материалу прилагают подписанное врачом сопроводительное письмо, в котором указывают: дату взятия материала, от животных какого вида и какой материал взят, сообщают эпизоотическую обстановку по ящуру в хозяйстве, имя врача. Материал отправляют с нарочным. Для работы с вирусом ящура в лаборатории выделяют отдельную комнату (бокс с предбоксником), где должно быть необходимое оборудование и материалы для проведения диагностической работы (подготовка материала, постановка РСК, биопробы и т.д.). При работе в боксе полностью сменяют спецодежду и обувь, надевают резиновые перчатки и маску. После работы ничего не обезвреженного выносить из бокса нельзя. Посуду и инструменты кипятят, спецодежду погружают в контейнер для автоклавирования; столы, пол, стены обрабатывают дезинфицирующим раствором с последующим облучением УФ-лучами.
В лаборатории ведут строгий учет поступившего материала и его расход с точностью до 1 мг. Поступивший в лабораторию материал хранят до исследования и в период использования в закрытом на ключ и опечатанном холодильнике. По окончании работы составляют акт на уничтожение оставшегося от исследования материала и животных после биопробы.
Лабораторные исследования на ящур включают:
-обнаружение и идентификацию антигена вируса ящура в РСК (определение его типовой и вариантной принадлежности);
-обнаружение и титрование антител к вирусу ящура у переболевших животных (реконвалесцентов) в реакции радиальной им-мунодиффузии (РРИД) и непрямой реакции иммунофлуоресцен-ции (НРИФ).
Обнаружение и идентификация антигена вируса ящура с помощью РСК. Компоненты реакции: испытуемые антигены из эпизоотических штаммов вируса от заболевших животных; сыворотки морских свинок, гипериммунизированных стандартными типовыми и вариантными штаммами вируса ящура (биофабричного производства); антигены контрольные — из типовых и вариантных штаммов вируса ящура (биофабричного производства); комплемент — свежая или сухая нормальная сыворотка морских свинок; гемолизин биофабричного производства; эритроциты барана — в виде 2%-ной взвеси на физиологическом растворе; 0,85%-ный раствор химически чистого хлорида натрия на дистиллированной воде; набор специфических сывороток и антигенов к другим вирусам, вызывающим везикулярные поражения.
![]() РСК ставят в различных объемах: в общем
объеме 1 мл — берут 0,2 мл каждого компонента, в общем объеме 0,5 мл — берут
0,1 мл каждого компонента или микрометодом — общий объем 0,125 мл, при этом
каждый компонент равен 0,025 мл.
РСК ставят в различных объемах: в общем
объеме 1 мл — берут 0,2 мл каждого компонента, в общем объеме 0,5 мл — берут
0,1 мл каждого компонента или микрометодом — общий объем 0,125 мл, при этом
каждый компонент равен 0,025 мл.
![]() Приготовление антигена вируса ящура.
Приготовление антигена вируса ящура.
Стенки афт от больных животных отмывают от консервирующей жидкости физиологическим раствором рН 7,4—7,6, высушивают фильтровальной бумагой, взвешивают, измельчают и тщательно растирают в фарфоровой ступке со стерильным битым нейтральным стеклом до получения однородной массы, к которой добавляют двойное по отношению к массе афт количество физиологического раствора (Dii 7,4—7,6), т. е. на 1г афт —2 мл раствора. Полученную 33% суспензию экстрагируют при комнатной температуре 2 ч, промц раживают при минус 10 — 20 "С в течение 5 — 18 ч. После размораживания центрифугируют 15—30 мин при 3000—5000 мин-1. Надосадочную жидкость инактивируют при 58 °С 40 мин. После инактивации, если в жидкости остаются хлопья, ее центрифугируй повторно 10—15 мин при 3000 мин-1 и затем используют в качестве антигена в РСК.
Этапы постановки РСК.
1. Титрование гемолизина. Проводят при получении новой серии по общепринятой методике. В главный опыт берут гемолизин в 4-кратной концентрации от его предельного титра (рабочее разведение).
2. Приготовление гемолитической системы (гемсистемы). Для этого смешивают гемолизин в рабочем разведении с равным количеством 2%-ной взвеси эритроцитов барана.
3. Титрование комплемента. Проводят в гемолитической системе в день постановки главного опыта по общепринятой методике. Для главного опыта РСК комплемент берут с излишком в 1 % от его титра в гемсистеме. Правильно взятая рабочая доза комплемента — непременное условие нормального течения реакции, что обеспечивает достоверность результатов.
4. Приготовление рабочего разведения типоспецифических сывороток. В главный опыт для определения типа вируса ящура сыворотки используют в удвоенном титре (от предельного титра), например, если предельный титр сыворотки составляет 1 :40, то рабочий титр будет 1 : 20.
5. Приготовление рабочего разведения типоспецифических антигенов. Антигены также используют в удвоенных титрах, например, если предельный титр равен 1 : 6, то рабочий титр будет 1 : 3.
6. Испытуемый антиген в реакции исследуют цельным ( 33%-ная взвесь) и в разведениях 1:2, 1:4 и 1:8.
Примечание. По представленным результатам все стандартные антигены и сыворотки активны и типоспецифичны. Испытуемый антиген относится к типу А.
Учет реакции ведут через 5 — 10 мин после водяной бани, и окончательный результат получают через 10— 12 ч. Степень задержки гемолиза оценивают в крестах: (++++) 100%-ная задержка гемолиза; (+++) — 75%-ная; (++) — 50%-ная; (+) — 25%-ная задержка гемолиза; (-) — полный гемолиз.
![]() Если испытуемый антиген гомологичен
специфическим антителам, то будет задержка гемолиза и реакция будет
положительной; если же гомологичные антитела отсутствуют, реакция отрицательная
и наблюдается полный гемолиз.
Если испытуемый антиген гомологичен
специфическим антителам, то будет задержка гемолиза и реакция будет
положительной; если же гомологичные антитела отсутствуют, реакция отрицательная
и наблюдается полный гемолиз.
При производственной необходимости после определения типовой принадлежности вируса ящура устанавливают его подтип (вариант). Для этого ставят РСК по той же методике, но используют вариантные сыворотки и вариантные антигены установленного типа. Причем вариантные сыворотки используют в предельном титре, а антигены в удвоенном. Антиген (исследуемый) относят к тому варианту, с сывороткой которого он дает положительную реакцию в более высоких разв Едениях .
Заключение. Испытуемый штамм относится к варианту A22.
Когда доставленного из хозяйства вирусного материа недостаточно для исследования в РСК, проводят его расплодку на культуре клеток или на 3-6-дневных мышатах-сосунах, или на взрослых морских свинках. Мышатам исследуемую суспензию вводят подкожно в области спины в дозе 0,1—0,2 мл, морским свинкам внутрикожно в подушечки обеих задних конечностей в дозе 0,2—0,5 мл. За животными наблюдают 5—7 дней.
В случае гибели мышат из их тушек готовят антиген для РСК. У морских свинок в положительных случаях на лапках образуются афты; стенки афт и их содержимое используют в РСК. При необходимости проводят 2—3 "слепых" пассажа. Пробу исследуемого материала считают отрицательной, если в третьем пассаже не будет отмечено дегенерации клеток и падежа белых мышей, а при исследовании полученных из них суспензий в РСК не будет обнаружен антиген вируса ящура.
Ретроспективная диагностика.
![]() Материалом для исследования на
наличие антител к вирусу ящура служат сыворотки крови животных, подозреваемых в
переболевании ящуром или другими везикулярными болезнями. Сыворотки крови
должны быть взяты не ранее чем через 7 дней с момента появления у животных
признаков везикулярного заболевания. На исследование следует направлять 5—10
проб сыворотки от животных каждой возрастной группы. При сомнительных
результатах первичного исследования необходимо отобрать кровь повторно от тех
же животных через 7— 10 дней.
Материалом для исследования на
наличие антител к вирусу ящура служат сыворотки крови животных, подозреваемых в
переболевании ящуром или другими везикулярными болезнями. Сыворотки крови
должны быть взяты не ранее чем через 7 дней с момента появления у животных
признаков везикулярного заболевания. На исследование следует направлять 5—10
проб сыворотки от животных каждой возрастной группы. При сомнительных
результатах первичного исследования необходимо отобрать кровь повторно от тех
же животных через 7— 10 дней.
Сыворотку, полученную общепринятым методом, консервируют антибиотиками (по 500 ЕД/мл пенициллина и стрептомицина) или замораживают при минус 20 °С. На исследование направляют от каждого животного не менее 5 мл сыворотки в термосе со льдом.
В лаборатории сыворотку исследуют с помощью реакции радиальной иммунодиффузии (РРИД) и реакции непрямой иммунофлуоресценции (НРИФ).
РРИД. Сущность реакции заключается в формировании зоны специфической преципитации вирусных антигенов антителами, включенными в состав агарового геля. РРИД типоспецифична.
Для постановки реакции расплавленный 2%-ный агар смешивают с равным объемом нагретой до 50—55 °С испытуемой сыворотки в разведениях 1 : 5, 1 : 10, 1 : 20 и т. д. до 1 : 320 и наносят по 4 мл на предметное стекло. В застывшем агаре вырезают лунки (диаметром 4—7,7 мм), которые заполняют эталонными типовыми антигенами. Затем стекла помещают во влажную камеру при температуре 37 °С. Результаты учитывают через 6—7 ч и окончательно через 18 ч.
Положительная реакция характеризуется образованием кольца преципитации в виде опалесцирующей зоны вокруг лунки с антигеном, гомологичным возбудителю, вызвавшему заболевание .
Антитела, обнаруженные в испытуемой пробе сыворотки, относят к тому серотипу, с антигеном которого они дали положительную реакцию. Их титром считают максимальное разведение испытуемой сыворотки, с которым наблюдается положительная реакция.
После переболевания животных титры антител обычно превышают 1 : 160.
![]() НРИФ. Данная реакция основана на том, что наличие антител в
сыворотке крови переболевших животных выявляет специфическое свечение
(комплекса антиген + антитело), а при использовании сывороток от
вакцинированных животных свечение комплекса не наблюдается.
НРИФ. Данная реакция основана на том, что наличие антител в
сыворотке крови переболевших животных выявляет специфическое свечение
(комплекса антиген + антитело), а при использовании сывороток от
вакцинированных животных свечение комплекса не наблюдается.
Техника постановки заключается в следующем. На препарат из культуры клеток ВНК-21, ПЭК, ПЭС, инфицированных вирусом ящура любого типа, наносят испытуемую сыворотку в разведении 1: 10 и 1 :20; инкубируют во влажной камере при 37 °С 30 мин; отмывают несвязавшиеся антитела; подсушивают на воздухе и окрашивают смесью рабочих разведений флуоресцирующей антивидовой сыворотки и бычьего альбумина, меченного родамином; Инкубируют во влажной камере при 37 °С 30 мин; отмывают; подсушивают и просматривают под люминесцентным микроскопом (объектив х40, окуляр х4 или х5). Положительная реакция характеризуется зеленым или из рудно-зеленым свечением цитоплазмы клеток.
Диагностический результат считают положительным при обнаружении специфического свечения хотя бы в одной из 5—10 сывороток, присланных из данного хозяйства.
Для определения уровня обнаруженных таким образом антител в испытуемой сыворотке проводят ее титрование. Для этого испытуемую сыворотку разводят от 1 : 40 до 1 : 1280, и каждым разведением обрабатывают заведомо инфицированный препарат, как было указано выше. О титре постинфекционных антител в сыворотке судят по предельному ее разведению, которое способно давать положительную НРИФ. Наличие специфического свечения в препаратах, обработанных испытуемой сывороткой в разведениях 1 : 10, 1 : 20 и 1 : 40, свидетельствует о том, что сыворотка была получена в период острого переболевания животного ящуром, т. е. с момента его заболевания прошло около 7 дней, а наличие специфического свечения в разведениях 1 : 80 и выше — о том, что сыворотка взята от животного-реконвалесцента.
Результаты исследования на ящур оформляют в виде протокола, в котором указывают дату исследования, наименование хозяйства, материала, краткие эпизоотологические данные и т. д. и обязательно наименование компонентов, используемых в исследовании, характеристику контролей.
Необходимо отметить, что для индикации и типирования вируса ящура разработано много других методов, таких, как ПЦР, РНГА, ИФА, метод перекрестного иммунитета и др.; для обнаружения и типирования антител — РН, РНГА, реакция серозащиты на мышатах-сосунах и др.
Дифференциальная диагностика. Необходимо исключить другие заболевания животных с везикулярным синдромом, такие, как ВД, ИРТ, везикулярный стоматит, у свиней — везикулярную болезнь, везикулярную экзантему, у овец — катаральную лихорадку.
Иммунитет и специфическая профилактика.
Продолжительность иммунитета у животных, переболевших ящуром, составляет 8—12 мес, у свиней 10—12, у овец — 18 мес. При очень напряженном иммунитете может наблюдаться некоторая устойчивость к заражению гетерологичным типом вируса. При ящуре возникает тканевой и гуморальный иммунитеты. Основное значение в защите животных от заболевания принадлежит гуморальным факторам иммунитета. Для специфической профилактики ящура применяют инактивированные вакцины. В нашей стране нашли широкое применение следующие 3 вакцины: лапинизированная гидро-окисьалюминиевая сапонинформолвакцина, которую готовят из вируса, репродуцированного в организме новорожденных крольчат; гидроокисьалюминиевая сапонинформолвакцина из вируса, культивируемого в ткани слизистой оболочки языка.
Для свиней используют противоящурную эмульгированную вакцину из лапинизированного вируса.
Иммунитет после вакцинации у взрослых животных длится 4— 6 мес. После ревакцинации иммунитет более напряженный и продолжительный.
Молодняк, родившийся от иммунных животных, получает пассивно антитела с молозивом. Антитела у телят сохраняются в течение 5 мес, хотя пассивная защита продолжается до 3—4 мес.
Инактивированные вакцины могут быть моно- или поливалентными, т. е. содержать антигены одного или многих типов и вариантов вируса. Живые вакцины против ящура не разработаны. Проводятся исследования по разработке и использованию синтетических вакцин, а также молекулярных вакцин, полученных с помощью методов генной инженерии.
4. Культивирование вирусов в культуре клеток
Культуры клеток и тканей – это кусочки органов и тканей, выращенных в питательной среде вне организма, сохраняют жизнеспособность, а некоторые размножаются.
Для культивирования необходимы:
- исходный материал (ткани эмбрионов, клетки почки, кожи, селезенки). Обязательо соблюдение правил асептики и антисептики;
- температура должна быть 36 -38 градусов Цельсия;
- питательная среда , которая должна обладать буферностью и изотоничностью, т.е. включать в себя Na, K, Ca, Mg, Cl, фосфаты, карбонаты;
- РН среды должна быть 7,2 – 7,4 единиц;
- все питательные элементы, особенно глюкоза, которая отвечает за энергетический обмен;
- аминокислоты;
- витамины, которые являются ко-ферментами.
Среды бывают двух видов:
1. натуральные или естественные ( кровь, амниотическая жидкость);
2. 2.синтетические и полусинтетические (из химических веществ, солевые растворы – раствор Эрла и раствор Хэнкса)
Методика сводится к следующему:
1. подбору культуры клеток;
2. получению вирус -содержащего материала;
3. подготовке для заражения;
4. заражению клеток вируссодержащим материалом;
5. культивированию вируса в клетках;
6. индикации вируса в культуре клеток;
7. сбору культуральной жидкости и идентификации в ней вируса.
Подбор культур клеток. Не всякая клетка чувствительна к любому вирусу. Вирус к первичной культуре обычно успешно адаптируется при условии, если культура получена из органов животного, естественно восприимчивого к данному вирусу. Однако адаптация вируса к перевиваемым клеткам более сложна, а в ряде случаев неосуществима. Для культивирования некоторых вирусов до сих пор неизвестно ни одной клеточной системы. Для культивирования вируса используют обычно молодые клетки, т. е. в первый день формирования монослоя, а в некоторых случаях (для парвовирусов свиней) клетки заражают при их посеве, так как вирус интенсивно размножается при наличии делящихся клеток (когда они находятся в стадии логарифмического роста).
Заражение клеток.
Для этого отбирают пробирки (или матрасы) со сплошным клеточным монослоем, просматривая их под малым увеличением микроскопа. Ростовую питательную среду сливают, клетки 1—2 раза промывают раствором Хенкса, чтобы удалить сывороточные антитела и ингибиторы. В каждую пробирку вносят по 0,1—0,2 мл вируссодержащего материала и покачиванием распределяют его равномерно по слою клеток. В таком виде пробирки (матрасы) оставляют от 1 до 2 ч при 22 или 37 "С для адсорбции вируса на поверхности клеток. Затем вируссодержащий материал удаляют из пробирок (матрасов) и наливают поддерживающую среду (в пробирку 1—2 мл, в матрасы около 10% его объема). При выделении вируса из патологического материала некоторые пробы (фекалий и др.) могут оказывать токсическое действие на клетки, поэтому после адсорбции вируса монослой клеток отмывают 1—2 раза раствором Хенкса (или питательной средой) и затем наливают поддерживающую среду.
Культивирование вируса.
Пробирки
(матрасы) закрывают герметически резиновыми пробками и ставят на инкубацию в
термостат при 37 °С. Наиболее широко применяют стационарное инкубирование. При
этом матрасы кладут в горизонтальном ![]()
![]()
![]() положении, пробирки — под углом 5°
так, чтобы монослой клеток оказался под питательной средой (чертой вверх). В
ряде лабораторий зараженные культуры клеток инкубируют на вращающейся системе
роллерах. Используя этот метод, удается получать большой выход вируса, имеющего
более высокий инфекционный титр, чем при стационарном культивировании.
положении, пробирки — под углом 5°
так, чтобы монослой клеток оказался под питательной средой (чертой вверх). В
ряде лабораторий зараженные культуры клеток инкубируют на вращающейся системе
роллерах. Используя этот метод, удается получать большой выход вируса, имеющего
более высокий инфекционный титр, чем при стационарном культивировании.
Для каждой пробы материала обычно используют не менее 4—10 пробирок с культурой клеток. Для контроля оставляют 4—6 пробирок с незараженной культурой клеток, в которых заменяют ростовую среду на поддерживающую.
![]() В культурах клеток, зараженных
вирусом, питательную среду можно не менять в течение 7 дней, а рН среды
(6,9—7,4) поддерживать с помощью 7,5%-ного раствора бикарбоната натрия. При
более длительном культивировании инфицированных клеток (аденовирусы и др.)
среду меняют.
В культурах клеток, зараженных
вирусом, питательную среду можно не менять в течение 7 дней, а рН среды
(6,9—7,4) поддерживать с помощью 7,5%-ного раствора бикарбоната натрия. При
более длительном культивировании инфицированных клеток (аденовирусы и др.)
среду меняют.
Все пробирки (матрасы) после заражения клеток ежедневно исследуют под малым увеличением микроскопа, сравнивая культуры клеток, зараженные вирусом, с контрольными.
![]() В термостате адсорбировавшиеся на
клетках вирусные частицы проникают внутрь их и начинается их репродукция. Новые
вирусные частицы покидают (полностью или частично) клетки, в которых они
образовались, проникают в непораженные клетки, репродуцируются в них, переходят
в новые клетки и поражают их. Так продолжается до тех пор, пока есть живые
неповрежденные клетки. В результате этого процесса практически все клетки в
матрасе или пробирке поражаются вирусом, хотя абсолютно все почти никогда не
поражаются.
В термостате адсорбировавшиеся на
клетках вирусные частицы проникают внутрь их и начинается их репродукция. Новые
вирусные частицы покидают (полностью или частично) клетки, в которых они
образовались, проникают в непораженные клетки, репродуцируются в них, переходят
в новые клетки и поражают их. Так продолжается до тех пор, пока есть живые
неповрежденные клетки. В результате этого процесса практически все клетки в
матрасе или пробирке поражаются вирусом, хотя абсолютно все почти никогда не
поражаются.
Вирус накапливается в основном в культуральной жидкости, но часть вирионов может оставаться и внутри не разрушенных вирусом клеток. Чтобы оставшийся в клетках вирус освободить, клетки тщательно разрушают или многократным замораживанием оттаиванием (2—3 раза), или с помощью ультразвука.
Индикация (обнаружение) вируса в культуре клеток.
Существуют следующие основные методы индикации вируса в культуре клеток: по цитопатическому эффекту, или цитопатическому действию (ЦПЭ,ЦПД); по положительной реакции гемадсорбции (РГАд); по образованию бляшек; по обнаружению внутриклеточных включений; по выявлению вирусов в реакции иммунофлуоресценции (РИФ); по обнаружению интерференции вирусов; по подавлению метаболизма клеток (цветная проба); электронной микроскопией и др.
ЦПД.
Наиболее широко и часто о размножении вируса в культуре клеток судят по цитопатическому эффекту, или цитопатическому действию. ЦПД называются любые изменения клеток под влиянием размножающегося в культуре клеток вируса. Физиологические изменения клеток установить довольно сложно, а морфологические изменения обнаруживаются довольно легко. Для этого достаточно положить на предметный столик микроскопа пробирку или матрас слоем клеток вверх и, используя малое увеличение (объектив х8—10, окуляр х7—10), осмотреть слой. Полезно сравнить клетки, зараженные вирусом, с такими же клетками в пробирке, не подвергавшимися заражению. В этом случае практически любые наблюдаемые в микроскоп отличия зараженной культуры клеток от контрольной можно считать проявлением ЦПД. Эти отличия могут захватывать весь монослой или отмечаться только в виде небольших очажков измененных клеток в слое нормальных клеток. Интенсивность ЦПД выражается тем, какая часть клеточного монослоя изменена вирусом. Хотя общепринятой системы оценки интенсивности ЦПД нет, ее часто оценивают в крестах или баллах. Так, если изменению (по сравнению с контролем) подвергся весь монослой в пробирке или матрасе, ЦПД оценивают на четыре креста, если 3/4 — на 3 креста, если 1/2 – на 2 креста, 1/4 — на один крест. Но эти оценки все же весьма условны.
Формы ЦПД зависят от биологических свойств вируса, вида клеток, дозы заражения, условий культивирования и т. д. Одни вирусы проявляют ЦПД через 2—3 сут после заражения (энтеровирусы), другие — через 1—2 нед (аденовирусы).
Наиболее существенно различаются между собой три формы ЦПД: фрагментация клеток, округление клеток, симпластообразование (рис. 1,2)
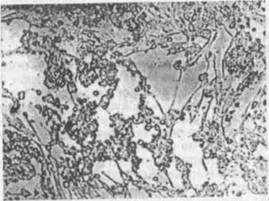
Фрагментация разрушение клеток на отдельные фрагменты, которые отделяются от стекла и переходят в культуральную жидкость в виде клеточного детрита (вирус везикулярного стоматита).
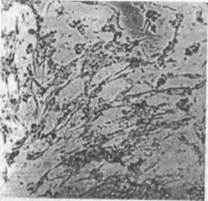
Округление потеря клетками способности прикрепляться к стеклу, вследствие чего клетки, обычно распластанные по стеклу, принимают шаровидную форму, отделяются от стекла и свободно плавают в культуральной жидкости, где и погибают (энтеровирусы, аденовирусы и др.).
Симпластообразование растворение клеточных оболочек, вследствие чего цитоплазмы соседних клеток сливаются, образуя одно целое, в котором располагаются (главным образом по периферии) ядра клеток. Такие образования из цитоплазматической массы с многими клеточными ядрами называются симпластами (гигантские многоядерные клетки). Их образование объясняют двояко: нарушением процесса деления клеток под влиянием вируса или тем, что некоторые вирусы содержат фермент (лецитиназу), который растворяет клеточные оболочки, в результате цитоплазмы расположенных рядом клеток сливаются. ЦПД в культуре клеток способно вызывать большинство вирусов, поэтому этот метод индикации вирусов в культуре клеток применяют очень широко. Однако есть вирусы, которые, размножаясь в культуре клеток, ЦПД не вызывают (вирусы бешенства, классической чумы свиней, некоторые штаммы вируса диареи крупного рогатого скота и др.). Клетки остаются жизнеспособными, но интенсивность клеточного деления понижается, со временем изменяется и их морфология.
При неопластической трансформации пораженных клеток в монослое образуются плотные фокусы трансформации различной величины и формы, белого цвета (вирус саркомы Рауса).
Отсутствие ЦПД в первом пассаже еще не говорит об отсутствии вируса, который не всегда размножается настолько быстро, чтобы вызвать ярко выраженное ЦПД. Поэтому и прибегают к "слепым" пассажам. Необходимо провести не менее трех "слепых" пассажей, прежде чем судить о наличии вируса в исследуемом материале.
РГАд. Гемадсорбция — соединение эритроцитов с поверхностью пораженных вирусом клеток — впервые была обнаружена Фогелем и Щелоковым (1957) на культуре ткани, инфицированной вирусом гриппа. В последующем выяснилось, что этой способностью обладает ряд других вирусов: парагриппозные, оспо-вакцины и оспы, ньюкаслской болезни, гриппа млекопитающих и птиц. Наиболее ценным оказалось применение этой реакции для выявления и идентификации парагриппозных вирусов животных (ПГ-3 крупного рогатого скота, парагриппа овец, вируса Сендай). В основе этого явления лежит родство рецепторов вируса, находящихся на поверхности пораженной клетки, с рецепторами эритроцита, что приводит к их взаимному сцеплению аналогично реакции гемагглютинации. Преимущество этой реакции состоит в том, что она становится положительной еще до появления отчетливых цитопатических изменений в инфицированных клетках. Для постановки реакции используют эритроциты морской свинки, обезьян, человека (группы О) и другие эритроциты, чувствительные к гемагглютинирующему действию изучаемого вируса.
Методика РГАд
Состоит в следующем. На 3—4-й день после инфицирования клеток берут две пробирки с одинаковой культурой клеток, из которых одна заражена вируссодержащим материалом, а вторая контрольная. Из обеих пробирок сливают культуральную жидкость и вносят в обе по 2—3 капли 0,5%-ной суспензии отмытых эритроцитов. Обе пробирки оставляют на 5—10 мин так, чтобы эритроциты были на поверхности клеток (кладут горизонтально на стол), а затем слегка споласкивают физраствором и исследуют под микроскопом (малое увеличение). В контрольной пробирке эритроциты полностью удаляются с физраствором, а некоторые из оставшихся плывут вместе с жидкостью. Если в зараженной пробирке эритроциты не удалились с физраствором и не плывут, а прикреплены к поверхности клеток, следует считать РГАд положительной
В зависимости от вируса и вида клеток расположение эритроцитов может быть трояким:
-эритроциты адсорбированы только по периферии клеточного пласта в виде "ожерелья" (вирус африканской чумы свиней);
![]() -эритроциты расположены на слое
клеток очагами или скоплениями (вирус гриппа);
-эритроциты расположены на слое
клеток очагами или скоплениями (вирус гриппа);
-эритроциты расположены на слое клеток диффузно (вирус парагриппа).
Каждый вирус способен адсорбировать эритроциты крови животных определенных видов. Если вирус на данной культуре клеток вызывает и ЦПД, и РГАд, то гемадсорбция проявляется раньше, чем ЦПД. Метод этот пригоден для индикации в культурах клеток только некоторых вирусов и поэтому применяется нечасто. Однако для индикации ряда вирусов (вирусы африканской чумы свиней, парагриппа-3 крупного рогатого скота и др.) он незаменим При отсутствии гемадсорбции на 3—4-й день после инфицирования через каждые 2—3 дня берут следующие пробирки с инфицированной культурой клеток и ставят РГАд по описанной выше методике. Пробирки с культурой клеток находятся под наблюдением в течение 14—20 дней. При отрицательной реакции гемадсорбции в первом пассаже проводят следующий пассаж и РГАд.
![]() РГАд используют для обнаружения
вируса в культуре клеток, для титрования его и при постановке реакции
нейтрализации с целью определения титра антител в сыворотках крови животных.
РГАд используют для обнаружения
вируса в культуре клеток, для титрования его и при постановке реакции
нейтрализации с целью определения титра антител в сыворотках крови животных.
Метод образования бляшек.
Этот метод обнаружения вирусов технически сложнее других и применяется главным образом для титрования вирусов.
Дальбекко и Фогт в 1954 г. впервые предложили методику получения бляшек под агаром в культуре куриных фибробластов с вирусом западного лошадиного энцефаломиелита. В последующие годы многие авторы с успехом применяли этот метод при изучении различных вирусов — ящура, везикулярного стоматита, ньюкаслской болезни, чумы птиц, полиомиелита, Коксаки и др. Метод бляшек стали широко применять в вирусологии для получения чистых популяций вируса, особенно при изучении их генетических свойств. Методику получения бляшек, предложенную Дальбекко и Фогтом, модифицировали, и в настоящее время есть целый ряд отличных друг от друга методов, связанных с изучением различных вирусов.
Метод бляшек основан на образовании вирусом в однослойных культурах, залитых агаровой средой, содержащей витальный краситель — нейтральрот, негативных колоний или бляшек. Бляшки представляют собой обесцвеченные участки культуры, состоящие из погибших под действием вируса клеток. Кроме агара в целях предотвращения переноса вируса на другие места можно использовать крахмал и метилцеллюлозу. Некоторые вирусы дают бляшки без покрытия слоем агара, например вирус чумы крупного рогатого скота, осповакцины, некоторые представители вирусов герпеса и др.
При постановке бляшек особое внимание должно быть обращено на качество культуры, она должна иметь сплошной рост клеток без признаков дегенерации. Лучше всего использовать культуры, выращенные во флаконах или матрасах различного типа. На клетки, промытые средой или раствором Хенкса, наносят вирус в определенных разведениях и обеспечивают контакт вируса с клетками при периодическом покачивании в точно установленный отрезок времени (1-2ч) при 37 -38 градусах Цельсия. Неадсорбировавшийся вирус удаляют путем промывания раствором Хэнкса или отсасывают пастеровской пипеткой, затем на слой клеток наносят специальное агаровое покрытие. Выбор среды покрытия определяется видом клеток и вируса.
Обычные компоненты агарового покрытия — агар, раствор Эрла, телячья сыворотка, нейтральный красный, раствор соды (NaHC03), среда, антибиотики.
После застывания (30—60 мин) с поверхности агара сливают конденсированную влагу, флаконы переносят в термостат и инкубируют клетками вверх. Время инкубации и температура должны быть оптимальными для бляшкообразования, вызываемого данным вирусом. Наблюдение за появлением бляшек проводят в течение нескольких дней. За это время вирусы, адсорбировавшиеся на клетках, проникают в последние, проходят цикл репродукции, выходят из клеток и поражают соседние клетки. В сплошном слое живых клеток возникают островки мертвых, погибших вследствие репродукции в них вируса клеток. Раствор красителя окрашивает только живые клетки. Поэтому в матрасе на ровном красновато-розовом фоне появляются бесцветные пятна, которые и называются негативными пятнами Дальбекко или бляшками. Каждая бляшка соответствует островку мертвых клеток. Бляшки в культуре клеток образуют многие вирусы. При большой плотности (соответствующей низким разведениям вируса) они часто сливаются друг с другом. Время появления и морфология бляшек зависят от вида и штамма вируса, типа клеток и условий культивирования.
В основу титрования вирусов положены наблюдения Дальбекко и Фогта, показавших линейную зависимость между дозой внесенного вируса и количеством образующихся бляшек. Они показали, что для образования одной бляшки достаточно одной инфекционной вирусной частицы. Однако это положение верно при определенных условиях, и, прежде всего, при внесении в культуру больших разведений вирусов, исключающих возможность множественного заражения клеток.
![]() Цветная проба.
Цветная проба.
Цветную пробу для лабораторных исследований впервые предложили Солк, Янгнер и Уорд в 1954 г. Предпосылкой для разработки данного метода явились наблюдения Эндерса, Уэллера и Роббинса, которые отметили, что в незаражен-ных тканевых культурах под влиянием продуктов метаболизма рН среды сдвигается вкислую сторону, что улавливается попожелтению фенолрота, добавленного в питательную среду. В то же время жидкость в тканевых культурах, зараженных вирусом, убивающим живые клетки, сохраняла свой красный цвет. Наиболее отчетливые результаты дают вирусы с высокой скоростью размножения при культивировании их на медленнорастущих клетках. Это способ не не отличается высокой достоверностью..
Обнаружение внутриклеточных включений.
При многих вирусных заболеваниях в клетках (в цитоплазме или ядре) различных органов и тканей появляются особые образования, называемые тельцами-включениями. Их классифицируют по локализации в клетке, составу нуклеиновой кислоты, тинкториальным свойствам и гомогенности.
Тельца-включения локализуются избирательно: при оспе, гриппе, бешенстве, парагриппе и других болезнях, как правило, развиваются цитоплазматические включения; при ринотрахеите крупного рогатого скота, ларинготрахеите птиц, аденовирусной инфекции и других — ядерные.
Для приготовления препаратов культур клеток с целью выявления телец-включений клетки выращивают на покровных стеклах в пробирках или пенициллиновых флаконах, заражают испытуемым материалом и через определенные сроки инкубации при 37 °С (что зависит от свойств инокулированного вируса) стекла вынимают, промывают в теплом растворе Хенкса или физиологическом растворе (рН 7,0—7,2), подсушивают фильтровальной бумагой и фиксируют в одной из фиксирующих смесей: растворе Буэна — 10—15 мин, фиксаторе Карнуа — 10, Ценкера—20—30, метиловом спирте —15 мин или в других фиксаторах. Затем препараты окрашивают.
![]() Вирусные тельца-включения хорошо
обнаруживаются в препаратах, окрашенных гематоксилин-эозином. Для этого
фиксированные на покровных стеклах клетки промывают в дистиллированной воде и
погружают на 5—15 мин в раствор гематоксилина (гематоксилин Майера, Эрлиха,
Карацци и др.). Время окрашивания подбирают эмпирически для каждой культуры
клеток и краски. Затем препараты отмывают водой и помещают на 1—2 мин в
аммиачную воду (на 200 мл дистиллированной воды добавляют 2—3 капли аммиака). В
щелочной среде ядра клеток приобретают синий цвет. Далее препараты окрашивают
0,1%-ным водным раствором эозина 30—60 с, удаляют лишнюю влагу фильтровальной
бумагой, проводят по спиртам возрастающей концентрации: 70, 80, 96 (первый
раз), 96 (второй раз), 100° + ксилол (1 : 1), ксилол и заключают в бальзам. В
каждом из спиртов и ксилоле препараты держат не более 1 мин. Перед перенесением
препаратов в следующую бюксу обязательно снимают с него фильтровальной бумагой
лишнюю влагу, иначе спирт будет обводняться. При окраске гематоксилин-эозином
ядра клеток окрашиваются в синий цвет, цитоплазма — в розовый, а
тельца-включения — в синий или розовый Для обнаружения телец-включений при
гриппе довольно часто используют окраску культур клеток по методу Клисенко. Для
этого стекла с зараженной культурой клеток споласкивают теплым (37 °С)
физиологическим раствором и фиксируют в жидкости Дюбоска — Бразила—Буэна от 20
мин до нескольких недель. Тщательно отмытые (3—4 раза) в дистиллированной воде
объекты окрашивают 10 мин 1%-ным раствором акридинового оранжевого, тщательно
отмывают дистиллированной водой, затем снова окрашивают 1%-ным раствором эозина
30 мин, промывают дистиллированной водой и допропитывают раствором (1 : 1000)
метиленового синего. Последний готовят перед употреблением из 1%-ного маточного
раствора.
Вирусные тельца-включения хорошо
обнаруживаются в препаратах, окрашенных гематоксилин-эозином. Для этого
фиксированные на покровных стеклах клетки промывают в дистиллированной воде и
погружают на 5—15 мин в раствор гематоксилина (гематоксилин Майера, Эрлиха,
Карацци и др.). Время окрашивания подбирают эмпирически для каждой культуры
клеток и краски. Затем препараты отмывают водой и помещают на 1—2 мин в
аммиачную воду (на 200 мл дистиллированной воды добавляют 2—3 капли аммиака). В
щелочной среде ядра клеток приобретают синий цвет. Далее препараты окрашивают
0,1%-ным водным раствором эозина 30—60 с, удаляют лишнюю влагу фильтровальной
бумагой, проводят по спиртам возрастающей концентрации: 70, 80, 96 (первый
раз), 96 (второй раз), 100° + ксилол (1 : 1), ксилол и заключают в бальзам. В
каждом из спиртов и ксилоле препараты держат не более 1 мин. Перед перенесением
препаратов в следующую бюксу обязательно снимают с него фильтровальной бумагой
лишнюю влагу, иначе спирт будет обводняться. При окраске гематоксилин-эозином
ядра клеток окрашиваются в синий цвет, цитоплазма — в розовый, а
тельца-включения — в синий или розовый Для обнаружения телец-включений при
гриппе довольно часто используют окраску культур клеток по методу Клисенко. Для
этого стекла с зараженной культурой клеток споласкивают теплым (37 °С)
физиологическим раствором и фиксируют в жидкости Дюбоска — Бразила—Буэна от 20
мин до нескольких недель. Тщательно отмытые (3—4 раза) в дистиллированной воде
объекты окрашивают 10 мин 1%-ным раствором акридинового оранжевого, тщательно
отмывают дистиллированной водой, затем снова окрашивают 1%-ным раствором эозина
30 мин, промывают дистиллированной водой и допропитывают раствором (1 : 1000)
метиленового синего. Последний готовят перед употреблением из 1%-ного маточного
раствора.
Окрашенные препараты промывают дистиллированной водой, дифференцируют в подкисленном (2—3 капли ледяной уксусной кислоты на 50 мл спирта) абсолютном спирте до появления розово-синего оттенка. Обезвоживают абсолютным спиртом и, проводя через ксилол, заключают в бальзам. Цитоплазма окрашивается в нежно-розовый цвет, ядро — в розово-сиреневый, ядрышки — в синий, вирусные включения — в ярко-красный .
Для окраски клеток крови, костного мозга или культур клеток из лимфоидных органов обычно применяют окраску по методу Романовского—Гимзы.
Обнаружение вирусов в реакции иммунофлуоресценции.
В том случае, если размножение вируса в культуре клеток не сопровождается цитопатическим эффектом, гемадсорбцией, его присутствие можно обнаружить с помощью флуоресцирующих антител. Этот метод широко используют при диагностике классической чумы свиней, парвовирусной инфекции свиней и других болезней.
Метод, основанный на интерференции вирусов.
Построен на том, что некоторые вирусы в культуре клеток снижают способность размножаться в ней других вирусов. Например, вирус чумы свиней снижает инфекционную активность вируса ящура, вирус ньюкаслской болезни — вируса везикулярного стоматита и т. д.
Получение первично-трипсинизированных культур клеток из кожномышечной ткани развивающихся куриных эмбрионов.
Куриные эмбрионы 9—11-дневной инкубации овоскопируют. Отбирают яйца с подвижными эмбрионами и хорошо выраженными сосудами. На скорлупе простым карандашом отмечают границы воздушной камеры и расположение зародыша.
Поверхность скорлупы протирают йодированным спиртом и обжигают. Стерильными ножницами срезают скорлупу на 2—3 мм выше границы воздушной камеры, разрывают подскорлупную и хорионаллантоисную оболочки и за шейку извлекают эмбрион в стерильную чашку Петри. У эмбриона удаляют голову, лапки, крылья и внутренние органы. Оставшийся кожномышечный мешок переносят в стерильную майонезную банку (250 мл) и измельчают ножницами на кусочки 3—4 мм.
Измельченную ткань 2—3 раза отмывают раствором Хенкса от слизи и кровяных элементов до получения прозрачных сливных вод и переносят в колбу для трипсинизации. В колбу наливают 0,15%-ный раствор трипсина, подогретого до 35—37 °С (соотношение ткани и трипсина 1 : 3), вносят стерильный магнитик и ставят на магнитную мешалку
Трипсинизацию проводят дробно, т. е. через каждые 3—5 мин отделившиеся клетки вместе с трипсином сливают в центрифужные флаконы и помещают на лед или в холодильник для прекращения действия трипсина на клетки. К оставшемуся в колбе содержимому добавляют новую порцию трипсина. Скорость вращения на магнитной мешалке регулируют так, чтобы не было пены. Процесс повторяют несколько раз (3—5) до полного истощения ткани.
После трипсинизации суспензию клеток в растворе трипсина центрифугируют при 1000 мин-1 10 мин, надосадочную жидкость сливают (выбрасывают), а осадок клеток ресуспендируют в теплой (37 °С) питательной среде (в заведомо известном объеме) и фильтруют через 3-слойный марлевый фильтр.
После тщательного перемешивания клеток берут 1 мл для подсчета клеток.
Успех культивирования клеток в значительной степени зависит от посевной дозы. При малом количестве клеток не наблюдается образование монослоя даже при длительном культивировании. При слишком большой дозе клеток происходит интенсивная их пролиферация, и образованный слой клеток значительно раньше подвергается старению и неспецифической дегенерации. Клетки подсчитывают в камере Горяева.
К 1 мл взвеси клеток добавляют равный объем 0,1%-ного раствора кристаллвиолета, приготовленного на 0,1 н. растворе лимонной кислоты. После перемешивания камеру заполняют взвесью клеток и подсчитывают все клетки, имеющие ядро и неповрежденную цитоплазму; группу клеток с явными контурами считают за одну клетку.
На основании подсчета клеток в двух камерах высчитывают среднее арифметическое в одной из них. Число клеток в 1 мл суспензии (X) определяют по формуле
Х**(А:2- 1000): 0,9,
где А среднее число клеток в одной камере; 2 — коэффициент разведения суспензии краской; 1000 — число мм3 в 1 см3; 0,9 — объем камеры Горясва, мм3.
После подсчета суспензию клеток разводят питательной средой с таким расчетом, чтобы в 1 мл содержалось от 700 тыс. до 1 млн клеток (для куриных фибробластов).
Пример. В 1 мл полученной суспензии клеток (100 мл) содержится 4 млн клеток. Следовательно, всего в 100 мл суспензии 400 млн клеток. Посевная концентрация 1 млн клеток в 1 мл. Исходную суспензию клеток (100 мл) доводят ростовой питательной средой до 400 мл.
Затем суспензию разливают в матрасы или пробирки. В пробирки заливают по 1 мл, в матрасы вместимостью 1000, 250 и 100 мл вносят соответственно 100, 40 и 15 мл взвеси клеток. Сосуды и пробирки плотно закрывают стерильными резиновыми пробками (для предупреждения защелачивания среды), делают надпись (вид культуры клеток и дату). На пробирках восковым карандашом проводят продольную черту, укладывают их чертой вверх в лотки с наклонным углом 5° и помещают в термостат при 37 °С.
Ежедневно культуры просматривают под малым увеличением микроскопа для определения характера роста. Если клетки не пролиферируют, выглядят округлыми, зернистыми, темными и отслаиваются от стекла, это свидетельствует о плохой обработке посуды или токсичности сыворотки, питательной среды. Пролиферирующие клетки светлые, связаны цитоплазматическими отростками, растут однослойным пластом. В процессе размножения клеток выделяются продукты обмена веществ, которые вызывают изменение рН питательной среды в кислую сторону (среда желтеет), что отрицательно влияет на клетки и может привести их к гибели. Такую среду заменяют свежей. Обычно сплошной монослой куриные фибробласты образуют через 36—48 ч.
От одного куриного эмбриона получают 70—120 млн клеток. Культуры клеток куриных фибробластов используют при работе с вирусом болезни Ауески, оспы птиц, ньюкаслской болезни, гриппа птиц, вируса саркомы Рауса и др.
Список литературы
1. Р.В. Белоусова, Э.А Преображенский, И.В. Третьякова "Ветеринарная вирусология" - М.: КолосС, 2007г.
2. В.Н.Сюрин, Р.В.Белоусова, И.В.Фомина "Ветеринарная вирусология" - М.: ВО " Агропромиздат", 1991г.
3. Р.В.Белоусова, Н.И.Троценко,Э.А.Преображенская "Практикум по ветеринарной вирусологии" - М.: КолосС, 2006г.
© 2010 Интернет База Рефератов