
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Реферат: Получение антисывороток и поликлональных антител
Реферат: Получение антисывороток и поликлональных антител
Реферат
по биологии
на тему:
"Получение антисывороток и поликлональных антител"
2009
1. Иммуногенность антигенов
Иммуногенность антигена - это способность в организме иммунизированного животного образования антител. Иммуногенность как биологическое свойство антигена является более сложным, чем антигенность. Антигенности того или иного вещества недостаточно, чтобы вызвать образование антител. В качестве примера можно привести гаптены, которые приобретают иммуногенность только после конъюгирования с соответствующим носителем.
Иммуногенность веществ сильно зависит от их молекулярной массы: чем выше молекулярная масса, тем выше иммуногенность. Отсюда вытекает важное практическое следствие - сшивка биополимеров между собой и другими белками повышает иммуногенность. Зависимость иммуногенности от молекулярной массы, по-видимому, определяется следующими причинами: во-первых, увеличение времени пребывания антигена в организме при возрастании его молекулярной массы; во-вторых, у высокомолекулярных антигеноа существенно возрастает способность взаимодействовать с макрофагами, в-третьих, с увеличением молекулярной массы в антигене увеличивается как общее количество антигенных детерминант, так и их разнообразие, что повышает эффективность взаимодействия] антигенов как с B-, так и с T-лимфоцитами.
Плотность расположения и количество антигенных детерминант на поверхности антигенов также имеет важное значение: по мере увеличения этих показателей иммуногенность в начале растет, а затем начинает уменьшаться. Так, например, для динитрофенильной гаптеновой группы было показано, что из конъюгатов, содержащих 3, 16 и 28 групп на молекулу бычьего альбумина, максимальной антигенностью обладал конъюгат, содержащий 16 молекул гаптена. Одной из причин такого эффекта, по-видимому, является сложность межклеточной кооперации. В частности, показано, что в иммунном ответе против антигенов, имеющих повторяющиеся антигенные детерминанты, участвуют только В-лимфоциты; такие антигены называются независимыми. Для этих антигенов, например полимеров. D-аминокислот, также характерно снижение скорости метаболизма в организме.
Очень важным является понятие "чужеродность" иммуногена. Установлено, что чем более антиген отличается по своей структуре от гомологичного антигена иммунизируемого животного, тем выше его иммуногенность. Например, инсулины человека и многих видов животных имеют близкую первичную структуру и поэтому для них инсулин человека малоиммуногенен. Однако между инсулином человека и морской свинки имеются достаточные отличия, что позволяет использовать этих животных как продуцентов соответствующих антисывороток. Однако это правило нельзя считать абсолютным. Так, например, гормон тироксин имеет одинаковую структуру у всех животных, тем не менее, будучи конъюгированным с подходящим белком, он становится хорошим иммуногеном. В данном случае антигенная детерминанта состоит не только из гормона, но и "ножки" и части белковой глобулы, что в целом создает "чужеродную" структуру. Именно на этом принципе основано получение антител против различных низкомолекулярных физиологически активных веществ.
"Чужеродность" зависит от генетических особенностей иммунизируемого животного, поэтому часто иммуногенность связывают с генетической чужеродностью антигена. Из "чужеродности" следует, что иммуногенность - это не абсолютное свойство антигена по отношению к данному виду животного, а иногда даже к индивидуальному организму. Необходимо иметь в виду, что иммунная система организма сама находится под жестким генетическим контролем, который определяет как биологическую активность различных участников иммунного процесса, так и многообразие специфичностей рецепторов, а значит, и специфичностей антител. Именно видовая и индивидуальная вариабельность организмов требует внимательного выбора вида животного. Чем менее "чужеродный" антиген, тем большее количество животных следует брать для иммунизации. Так, например, для получения антисывороток против инсулина наиболее иммунореактивными являются морские свинки, при этом в среднем только одна из семи морских свинок дает удовлетворительную для целей анализа антисыворотку. Даже в случае получения антисывороток против достаточно "чужеродных" антигенов необходима большая группа животных, так как в этом случае нивелируются индивидуальные различия. Смесь антисывороток против данного антигена от разных животных одной группы называют пулом.
Из лабораторных животных чаще всего берут для иммунизации кроликов, морских свинок или мышей в зависимости от количества имеющегося антигена, доступности животного и т.д. Возможность использования группы лабораторных животных позволяет решить проблему отбора из них наиболее иммунореактивных. Иммунизировать удобнее самцов, так как у них иммуногенный ответ менее подвержен влиянию гормональных циклов. Для получения антител против вирусов эффективными оказались куры, у которых антитела накапливаются в яйцах. Большие количества антисывороток получают иммунизацией крупных животных: козлов, баранов, ослов, лошадей.
Для получения специфических антисывороток важное значение имеет гомогенность антигена. Это обусловлено тем, что примеси чужеродных антигенов могут обладать большей иммуногенностью, чем основной антиген, в результате чего, несмотря на небольшое количество примеси, против нее может образоваться достаточное количество антител. Так, например, вирусные антигены, выделенные из культуры ткани животных, содержат примесь тканевых антигенов, против которых вырабатываются антитела, дающие ложноположительные реакции в иммунохимическом анализе.
Степень иммунного ответа также зависит от количества введенного антигена. При определенных концентрациях антигена, как высоких, так и низких, наступает торможение гуморального иммунного ответа, называемое толерантностью. Это обусловливает необходимость выбора оптимальной дозы в каждом конкретном случае, с учетом чистоты препарата и его иммуногенности. Доза иммуногена для одной инъекции кролику или морской свинке составляет в среднем 100-300 мкг на 2 кг массы. Доза, необходимая для крупных животных, не увеличивается пропорционально их массе. Так, для овец достаточна доза, равная 0,25-5 мг иммуногена на инъекцию, для осла - 0,5-10 мг. В случае использования в качестве иммуногена конъюгата гаптенноситель доза зависит от молекулярной массы конъюгата.
Способ введения антигена и периодичность введения влияют на иммунологическую активность антисывороток. Так как иммунный ответ формируется в организме постепенно, принято различать первичный ответ и вторичный ответ. Первичные и вторичные антисыворотки отличаются по составу антител и их специфичности. Обычно высокоактивные антисыворотки получают после нескольких циклов иммунизации. Однако очень длительные иммунизации могут привести к снижению специфичности из-за постепенного увеличения титра антител к примесным антигенам.
В процессе иммунизации изменяется также аффинность и соотношение между различными фракциями антител. Такая вариабельность качества антисывороток по специфичности антител, их физико-химическим свойствам и концентрации является следствием популяционной природы иммунного ответа. В связи с этими обстоятельствами на практике необходимо вести непрерывный контроль за качеством получаемых антисывороток.
2. Получение иммунных антисывороток
Адъюванты - это соединения, которые при введении в организм вызывают неспецифическое усиление иммунного ответа и тем самым повышают способность организма реагировать на любой иммуноген. Адъювантными свойствами обладают масла, липосомы, клетки бактерий, полимеры и др. Адъюванты, введенные в организм вместе с иммуногеном, выполняют две функции. Во-первых, они способствуют более медленному освобождению иммуногена из участков инъекции, что замедляет его поступление в кровоток, в результате чего увеличивается вероятность встречи иммуногена с иммунокомпетентными клетками, а также резко снижается его токсичность. Во-вторых, адъюванты вызывают сильное воспаление в месте введения иммуногена, при этом активируется фагоцитоз и стимулируется местная циркуляция лимфоцитов, происходит неспецифическая стимуляция иммунокомпетентных клеток. Для усиления такой неспецифической иммуностимуляции в состав адъюваитов дополнительно включают препарат бактериальных клеток рода Bacillus pertussium.
В настоящее время для целей иммунизации широко применяется коммерческий препарат полного адъюванта Фрейнда, в состав которого входят смесь минеральных масел, эмульгатор и убитые микобактерии. Препарат адъюванта можно приготовить в лабораторных условиях, тщательно смешав три части минерального масла, одну часть безводного ланолина, четыре части 0,15 M К-фосфатного буфера и препарат микобактерии до конечной концентрации 10 мг/мл так, чтобы частички микобактерии равномерно распределились по всему объему. Адъювант смешивают с водным раствором иммуногена в отношении 2: 1 до образования нерасслаивающейся эмульсии, в которой водный раствор иммуногена находится в мицеллах.
Использование в иммунизации адъюванта снижает возможность появления толерантности, позволяет расширить диапазон вводимого иммуногена от 50 до 200 мкг на одну инъекцию. После введения адъюванта у животных часто образуются гранулемы, которые влияют на самочувствие животных, поэтому в течение иммунизации необходимо тщательно наблюдать за состоянием здоровья животного. В случае ухудшения самочувствия очередную инъекцию пропускают и лишь после выздоровления животного продолжают иммунизацию.
Способы иммунизации. Введение иммуногена приводит к активации лимфоидных клеток, расположенных вблизи от места инъекции. Наиболее эффективно вводить иммуноген малыми порциями в большое количество точек. Введение иммуногена можно осуществлять различными способами.
Внутрикожное введение. На очищенном от шерсти участке кожи животного делают острым скальпелем несколько царапин, а затем втирают в это место раствор иммуногена. Применение этого способа позволяет получать высокий иммунный ответ уже после однократного введения, в результате чего значительно сокращается расход иммуногена. Однако описанный способ трудоемок в исполнении и обычно вызывает сильные болевые ощущения у животного от обширных участков изъязвлений в местах введения иммуногена.
Подкожная иммунизация. В точки, расположенные вдоль позвоночника животного, вводят 5-6 порций раствора иммуногена объемом приблизительно 2 мл.
Внутримышечное введение. Одновременно часть иммуногена вводят в мышцу задних ног животного и небольшими порциями.
Внутрибрюшинное введение. Этот способ используют для иммунизации мелких лабораторных животных, таких, как мыши или морские свинки.
Прямое введение иммуногена в лимфатические узлы. Иммуноген инъецируют в лимфоидные узлы, расположенные в подколенной ямке задних ног кролика, что позволяет уменьшить его количество до 10-50 мкг, а объем вводимого раствора - до 25 мкл. Этот способ является сложным в техническом исполнении, поскольку включает в себя разрез кожи, поиск лимфоузла и введение иммуногена без его повреждения.
Внутривенное введение. Этот способ обычно применяется для повторных инъекций, после которых проводят отбор крови у животного. Раствор иммуногена вводят непосредственно в кровоток. Адъювант в этом способе введения антигена не применяется, поскольку он оказывает токсический эффект и животное может погибнуть.
Более редко используются такие способы иммунизации, как введение иммуногена в подушечки лап или в конъюнктиву глаза, которые вызывают сильные болевые ощущения у животного. Иммунизацию начинают введением животному иммуногена в смеси с полным адъювантом Фрейнда, а для повторных инъекций применяют неполный адъювант Фрейнда. Перед отбором крови за 7 - 9 дней проводят 1-3 внутривенных инъекций для повышения уровня антител. Число инъекций и интервалы между ними чаще всего подбираются экспериментально для конкретного иммуногена.
В процессе иммунизации у животных отбирают небольшие пробы крови для оценки количества антител. Максимальный уровень иммунного ответа на введение большинства растворимых антигенов достигается через 40-60 дней после первой инъекции. В том случае, когда иммуногеном являются клетки микроорганизмов, максимально высокий уровень антител наблюдается гораздо раньше. После окончания первого цикла иммунизации животному в течение 30 дней дают восстановить здоровье и проводят реиммунизацию, включающую 1-3 внутривенные инъекции. Ниже приводятся схемы иммунизации морских свинок и кроликов инсулином и конъюгатом тироксин - бычий сывороточный альбумин.
Для получения антисывороток морских свинок к инсулину свиньи проводят многоточечные инъекции инсулина подкожно, внутримышечно и внутрибрюшинно по следующей схеме: 1, 8, 15-й день - 200 мкг инсулина в 0,5 мл физиологического раствора смешивают с 0,5 мл полного адъюваита Фрейнда и вводят животному. После 30 дней отдыха животному в течение 3 дней ежедневно вводят антиген путем многоточечных инъекций по схеме: 45, 46, 47-й день - 150 мкг инсулина в 0,7 мл физиологического раствора. Отбор крови проводят через 7-9 дней из сердца.
Второй цикл иммунизации осуществляется после месячного отдыха животных по схемам 45, 46 и 47 дней.
Для получения антисывороток с титром, удовлетворительным для проведения ИФА, часто требуется 4-5-кратное повторение циклов иммунизации. Отбор крови каждый раз проводится на 7 - 9-й день после последней инъекции.
Иммунизацию кроликов конъюгатом тироксин - БСА проводят многоточечными инъекциями вдоль позвоночника и внутримышечно в область микроузлов задних лап по следующей схеме: 1-й день - 1-2 мг конъюгата.
T4 - БСА в 0,7 мл физиологического раствора смешивают с 0,7 мл адъюванта Фрейнда и полученную эмульсию вводят животному; 31, 32, 33 или 45, 46, 47-й дни - внутривенно вводят 0,7-1 мл физиологического раствора, содержащего 1-2 мг T4 - БСА.
Кровь берут из сердца на 7-9-й день после последней инъекции. Через месяц цикл внутривенной иммунизации, повторяют.
Отбор крови и получение антисыворотки. Иммунизированное животное используется в качестве донора иммунной сыворотки в течение 5-7 мес, за это время удается провести 5-6 циклов иммунизации. Животных, прошедших несколько циклов иммунизации, называют гипериммунными. Кровь у животных отбирают из вены уха или непосредственно из сердца путем кардиальной пункции в объеме 50-70 мл у кролика и 5-10 мл у морской свинки в стерильные пробирки, промытые стерильным буферным раствором.
Кровь, лишенная клеточных элементов, называется плазмой. В плазме содержится фибриноген, приводящий к образованию во всем объеме пробирки сгустка фибрина, который осторожно удаляется центрифугированием при 1000-2000 об/мин в течение 15 мин. Плазма, лишенная фибрина, называется сывороткой. Для удаления белков системы комплемента сыворотку прогревают в течение 30 мин при 56°С, при этом антитела сохраняют свою активность. Обработку крови и получение сыворотки надо проводить с максимальной осторожностью, избегая разрушения эритроцитов. Наличие внутриклеточных белков и ферментов в сыворотке может приводить к появлению дополнительного фона в некоторых модификациях иммуноферментного анализа. Это замечание касается прежде всего использования антисывороток в гомогенных методах.
Хранение антисывороток. Нативную иммунную сыворотку можно хранить 3-6 мес без потери иммунологической активности в замороженном состоянии при - 20°С, предварительно разливая ее во флаконы по 0,5-1 мл. Отмораживание-замораживание ведет к снижению иммунологической активности сыворотки, поэтому лучше замораживать ее небольшими порциями для одноразового употребления.
Удобно хранить антисыворотку в лиофилизованном состоянии в ампулах под вакуумом. В сухом виде антисыворотка сохраняет иммунологическую активность при комнатной температуре в течение 1-2 лет.
Размороженную или разведенную сухую сыворотку в растворе можно хранить при +4°С в течение недели, предварительно добавив в нее консервант - хлороформ, 0,1% азида натрия или 0,01% мертнолата. Следует иметь в виду, что консерванты могут быть ингибиторами ферментов-маркеров в иммуно-феремнтном анализе.
3. Выделение и очистка антител
Для увеличения относительного количества антител обычно используют г-глобулиновую или IgG-фракции иммунной сыворотки. Наиболее полное выделение г-глобулиновой фракции без снижения ее иммунологической активности достигается при осаждении сульфатом аммония, после чего осадок длительно диализуется с частой сменой буферных растворов.
Другим широко распространенным способом является осаждение полиэтиленгликолем с Air=4000-6000. В 10% -иом растворе полиэтиленгликоля происходит агрегация всех белков с Мг> ~> 150 000, в результате чего осаждаются белки г-глобулиновой фракции, а белки меньшей молекулярной массы остаются в растворе. Этот метод позволяет очень быстро получить препарат г-глобулиновой фракции антисыворотки. Способ достаточно эффективный, если препарат не подвергается хранению при низких температурах. Длительное хранение полученного препарата с сохранением иммунологической активности возможно после предварительного тщательного диализа.
Антитела в большей части антигенов относятся к IgG-фракции иммунной сыворотки. С целью повышения чувствительности и специфичности анализа во многих случаях полезно использовать для сорбции на твердой фазе и для получения конъюгатов IgG-фракцию нативной сыворотки. Наиболее простой и доступный способ выделения IgG - метод ионообменной хроматографии на ДЗАЭ-сефадексе или ДЗАЭ-целлюлозе.
Выделение IgG-фракции кроличьей аитисыворотки.
1. 10 мл аитисыворотки кролика разбавляют в 2 раза 0,15 M NaCl1 добавляют 6,26 г 2SO4, перемешивают и инкубируют 12-16 ч при 4°С.
2. Выпавший осадок удаляют цеитрифугироваиием, растворяют в 10 мл фосфатного буфера и затем диализуют против того же буфера в течение ночи при комнатной температуре.
3. После удаления осадка центрифугироваиием раствор наносят на колонку с ДЭАЭ-целлюлозой, уравновешенную фосфатным буфером.
4. IgG-фракцию определяют, измеряя оптическую плотность элюата при 280 им, концентрацию рассчитывают, используя коэффициент молярного поглощения е=1,5 г-'-л-см-1.
Приготовление фосфатного буфера.
Для выделения IgG кролика используют 50 мМ фосфатный буфер, содержащий 20 мМ ЭДТА.8 г Na2HPO4 ·2З20 н 7,4 г ЭДТА-Na растворить в 900 мл воды, довести рН до 8 IM NaOH и затем добавить воды до 1 л.
Выделение антител методом иммуносорбции. Специфичность сыворотки проверяется в реакциях с используемым для иммунизации препаратом антигена и с набором близких ему по структуре химических соединений. В случае недостаточна очищенного антигена возможны неспецифические реакции, обусловленные наличием антител к применяемым антигенам. Перекрестные реакции с другими соединениями могут наблюдаться при наличии у них химических структур, близких к структуре антигенных детерминант иммуногена.
Удаление неспецифических антител из антисыворотки обычно осуществляют с помощью метода адсорбции на соответствующем неспецифическом антигене. Адсорбция неспецифических антител в реакции преципитации с растворимой фракцией путем центрифугирования может привести к появлению в антисыворотке или растворимых комплексов At-Ar, или избытка добавленного Ar, присутствие которых влияет на способность антисыворотки реагировать со сцецифическим антигеном в ИФА. Наиболее удобно для адсорбции антисыворотки использовать антиген, иммобилизованный на твердой фазе. Добавляя такой иммуносорбент в антисыворотку или пропуская антисыворотку через колонку с иммуносорбентом, можно быстро освободиться от перекрестно реагирующих антител.
Метод аффинной хроматографии на иммуносорбентах используется для получения препаратов очищенных антител. Наиболее широкое распространение лолучили иммуносорбенты на основе CNBr-активированной сефарозы. Выпускаемая в нашей стране CNBr-активированная агароза по своим основным параметрам не уступает зарубежному аналогу.
Основные операции, используемые для получения иммобилизованных на CNBr-агарозе антигенов или антител, приведены в табл.5.1.
Следует отметить, что при работе с иммуносорбентами на основе CNBr-активированной сефарозы нельзя использовать буфер, содержащий аминогруппы.
Получение фрагментов антител. При разработке некоторых модификаций ИФА может возникнуть необходимость использования конъюгатов фермента не с целой молекулой иммуноглобулина, а с тем ее фрагментом, который специфически связывается с молекулой антигена - Fab-фрагментом. Обусловлено это прежде всего тем, что Fc-фрагмент молекулы, ответственный за эффекторные функции иммуноглобулина, обладает способностью неспецифически взаимодействовать с другими белками, сорбированными на носителях при проведении твердофазного ИФА. Эффект неспецифической сорбции определяется природой антигена, концентрацией сорбированного на носителе белка и рядом других факторов.
Таблица 5.1. Ковалентное связывание с CNBr-активированной сефарозой
| Операция | Условия |
|
1" Взвесить требуемое количество CNBr-активирован ион сефарозы 2. Промыть на стеклянном фильтре и дать набухать гелю 3. Растворить в буфере белок 4. Смешать белковый раствор с суспензией геля 5. Блокировка оставшихся активных групп 6. Отмывка от несвязавшегося антигена |
1 г высушенного препарата дает около 4,5 мл геля Использовать для промывки раствор 1 мМ HCl, а затем для уравновешивания и набухания - боратный или гидрокарбонатный буфер Использовать гидрокарбонатный или обратный буфер Гидрокарбонатный буфер: 0,1 M NaHCO3, содержащий 0,5 NaCl Раствор должен содержать 5-10 мг антигена Два часа при комнатной температуре или ночь при +4 °С Гель промывается буфером, содержащим блокирующие соединения. Используются IM этаиоламин или 0,2 M глицин, рН 8,0 Используется буфер, в котором осуществлялось ковалентное связывание, затем 0,1 M ацетатный буфер, рН 4, содержащий 0,5 M NaCl, после, чего гель опять уравновешивается боратным или гидрокарбонатным буфером |
Получение Fab-фрагментов.
1. Готовят раствор, содержащий 0,1-3 мг Р2-фрагмента в 0,45 мл 0,1 M Na-фосфатиом буфере, рН 6,0. ·
2. Добавляют 0,05 мл 0,1 M 2-меркаптоэтанола в том же буфере, содержащем 5 мЛ\ ЭДТА.
3. Смесь инкубируют при 37 0C в течение 1,5 ч.
4. Тестирование антисывороток.
Антисыворотки, полученные даже от одного животного, значительно различаются по своей способности связывать антиген. Для сравнительной характеристики и оценки качества антисывороток проводят их тестирование, которое позволяет решить следующие две важные задачи: во-первых, произвести отбор именно тех сывороток, которые по своим свойствам удовлетворяют требованиям иммунохимического анализа, во-вторых, осуществить стандартизацию антисывороток при их промышленном производстве для иммуноферментных наборов.
Первичный отбор антисывороток проводят на основании нахождения их титра, который представляет собой интегральный параметр, характеризующий взаимодействие с антигеном. Более детальные сведения о сыворотке получают, определяя аффинность и концентрацию антител. Следующий этап - это установление антигенной специфичности антител, т.е. возможности взаимодействовать со структурно сходными антигенами.
Принципиальное различие этих этапов заключается в следующем: при определении титра исследуют связывание выбранной концентрации антигена при различных разведениях аитисыворотки. При определении аффинности и концентрации антител исследуют связывание антисыворотки с различными концентрациями меченого антигена. При изучении специфичности антисывороток в соответствующем разведении и при постоянной концентрации меченого антигена добавляют различные концентрации перекрестно реагирующего антигена.
Во всех случаях используют концентрации антигена либо близкие к минимально детектируемым в данном виде анализа, либо в том диапазоне, который соответствует их концентрации в Образце.
Определение титра аитисыворотки. Титр - это эффективная величина, характеризующая связывающую способность антител, зависящая от их концентрации и аффинности. Абсолютное значение титра также зависит от метода и условий проведения эксперимента и от начальной концентрации свободного антигена.
Количественно титр находят как предельное разведение сыворотки, при котором еще наблюдается положительный регистраруемый данным методом эффект взаимодействия антисыворотки с антигеном. Например, если титр устанавливают методом преципитации свободного антигена в геле и для первой сыворотки образование преципитата наблюдается при разведении в 2т раза, а для другой - в 2" раз, фп титр первой сыворотки равен 2т, а второй - 2", причем вторая антисыворотка менее активная, чем первая. Иногда оперируют понятием "50% -ный титр", подразумевая под этим, соответственно, разведение сыворотки, вызывающее 50% -ное связывание антигена. "Рабочим титром" называют то начальное разведение сыворотки, которое используют непосредственно в эксперименте.
Таблица 5.2. Схема тестирования сывороток
| Этап исследования | Условия | Цель |
|
Титр Аффинность Специфичность |
- постоянна - варьирует постоянна варьирует постоянна - постоянна варьирует |
Отбор высокоактивных иммунных аитисывороток, определение конечного и рабочего титра Оценка аффинности и концентрации фракции высокоаффиниых антител Определение специфичности антител |
Титр антисыворотки сильно зависит от концентрации антигена, используемого для тестирования и от способа его определения. Например, одна и та же сыворотка может иметь титр 100 в тесте иммунопреципитации и 100 000 в тесте иммуноферментного анализа. Поэтому при тестировании сыворотки и определении титра лучше всего применять тот же метод, что и при анализе, а концентрацию антигена выбирать близкую к минимальной в том диапазоне, который выбран для анализа. Кроме того, следует учитывать, что в иммуноферментном анализе используют как гомогенные, так и гетерогенные методы определения концентрации антигена, которые могут сильно отличаться по структуре образующихся иммунных комплексов. В частности, в твердофазных методах вероятность образования циклических комплексов антиген - антитело значительно меньше, чем в гомогенных, а следовательно, и наблюдаемая аффинность антител в обеих системах будет разная.
При разработке методов ИФА обычно пользуются значением титра антисыворотки, определенным в непрямом методе, в котором на стенках лунок микроллаты первоначально сорбируют антиген и затем изучают связывание с ним иммунной сыворотки в последовательных разведениях. Связывание исследуемых антител с иммобилизованным антигеном регистрируют с помощью антивидового конъюгата к иммуноглобулиновой фракции сыворотки животного, используемого для иммунизации.
Результаты в этом случае обычно оценивают с помощью понятия "50% -ный титр". На рис. приведены кривые титрования антисывороток к инсулину, полученных иммунизацией морских свинок. Максимальный сигнал, регистрируемый по оптической плотности А продукта реакции окисления перекисью водорода 5-аминосалициловой кислоты, составляет ~1,4 оптических единиц. За титр сыворотки принимается ' такое разведение, при котором оптическая плотность, регистрируемая в ИФА, имеет значение, близкое к 0,7.
Обычно такой подход используется в качестве 1-го этапа оценки качества полученных иммунных сывороток и позволяет отобрать высокоактивные иммунные сыворотки. Однако для более глубокой оценки полученных антител проводят определение их аффинности. При разработке методов ИФА ряда антигенов, присутствующих в биологических жидкостях в низких концентрациях порядка Ю-10-IO11M, должны быть использованы антисыворотки, имеющие не только высокий титр, но и достаточное содержание антител, обладающих высокой константой связывания.
Аффинность антител. В основном в таких экспериментах применяются иммобилизованные антитела и антигены, меченные радиоактивной меткой.
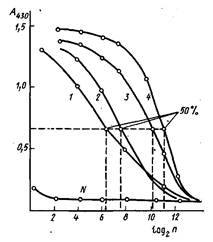
Титрование антисывороток к инсулину методом непрямого твердофазного ИФА: по оси абсцисс - разведение разбавленной в 100 раз сыворотки, по оси ординат - оптическая плотность при 430 им продукта пероксидазного окисления 5-аминосалициловой кислоты перекисью водорода. В качестве контроля - использована сыворотка крови неиммунизированного животного.
При использовании ферментных меток химическая структура меченого антигена может существенно отличаться от немеченого. В этих случаях полученные значения констант связывания характеризуют, как правило, взаимодействие в данной конкретной системе, вследствие - чего иммунная сыворотка, обладающая высокой аффинностью в реакции с конъюгатом одной структуры, может иметь значительно более низкие значения константы связывания с конъюгатом, полученным другим способом.
Если исследователь имеет дело с разработкой конкурентных методов ИФА, т.е. располагает набором иммунных сывороток и конъюгатом антиген-фермент, то важным этапом создания тест-системы является выбор пары антитело - конъюгат, характеризующейся Необходимой константой взаимодействия. Для проведения скрининга у-глобулиновую фракцию каждой антисыворотки иммобилизуют на поверхности микропланшета и изучают ее связывание с имеющимся набором конъюгатов. Эффективное значение связи является величиной, обратной значению концентрации конъюгата, при которой связывается 50% активных центров на носителе.
На рис. приведены кривые связывания иммобилизованных на полистироле антител к инсулину с конъюгатом инсулин - пероксидаза. Исследуемые сыворотки различаются по значениям эффективных констант равновесия. Для количественного определения инсулина могут быть использованы антисыворотка и конъюгат, эффективная константа связывания которых ~109 M-1. Для других тест-систем допустимое значение Кзф будет определяться требованиями, предъявляемыми к чувствительности и точности разрабатываемого метода.
Описанная процедура скрининга иммунных сывороток, как отмечалось выше, применима при наличии конъюгата антиген – фер.
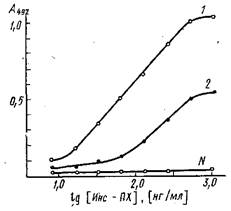
Связывание конъюгата инсулин - пероксидаза с адсорбированными на полистирольном планшете антителами против инсулина, выделенными из разных сывороток: по оси ординат - оптическая плотность А при 490 нм продукта пероксидазной реакции окислення о-фенилендиамина перекисью водорода. Константы связывания антител из сывороток / и 2 равны Ю'о н 109 соответственно; N-контрольная нормальная сыворотка.
Получение такого конъюгата для широкого круга антигенов представляется непростой задачей. Более универсальным реагентом являются антитела, меченные ферментом, поэтому остановимся на более общем подходе к определению аффинности антител в сыворотке или асците, основанном на твердофазном ИФА. Этот метод, предложенный Б. Фриге, позволяет определять константу связывания антител с антигеном при их взаимодействии в растворе.
Постановка метода включает две основных стадии:
1) проведение реакции антиген - антитело в растворе;
2) определение концентрации антител после установления равновесия с помощью метода твердофазного ИФА. Схема реакции в растворе в общем случае имеет вид
![]()
Обозначим равновесную концентрацию связанных антител как Bp, а концентрацию свободного антигена как Fj,, тогда можно записать следующее выражение:
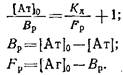
Если концентрации антител 0 и определять методом непрямого твердофазного ИФА, то при определенных условиях проведения эксперимента. будет выполняться соотношение / о=Л/Л0, где А и A0 - значения оптических плотностей, регистрируемых в ИФА, соответствующие концентрациям антител и о. Уравнение Клотца при этом условии может быть приведено к виду
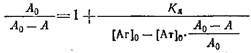
Таким образом, для определения Кл описанным выше методом необходимо знание начальной концентрации антител о. Однако практически нахождение Кл проводится в иммунных сыворотках, или асцитах, где точная концентрация антител |Ат] о неизвестна. Если проводить реакцию комплексообразоваиия в избытке антигена, то количество связавшегося антигена незначительно по сравнению с исходным и его концентрация после установления в системе равновесия будет близка к исходной ф е.0 да. Fp. Если эксперимент проводится так, что выполняется условие о > 10 о, то
![]()
полученные радиоактивной меткой.
Если представить экспериментальные данные в координатах A0/-=-1/0> то по тангенсу угла наклона прямой можно рассчитать Кд.
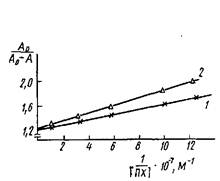
Определение константы диссоциации комплекса пероксидаза - антитела к пероксидазе в координатах Клотца: кривые 1 я 2 соответствуют значениям Cd 1,1 ·10-9 и 2.2 ·10-9 M.
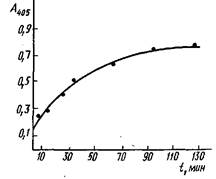
Кинетика связывания моноклональных антител с инсулином, адсорбированным иа полистирольном планшете для ИФА из раствора концентрации 1 мкг/мл. Комплекс инсулин - антитело выявлен меченными пероксидазой антимышинными IgG:
Таким образом, для практического осуществления' описанного метода необходимо, прежде всего, установить наличие линейной зависимости между концентрацией определяемых непрямым методом ИФА антител и регистрируемым значением оптической плотности. Для этого готовят серии разведений исследуемой иммунной сыворотки и изучают их связывание в непрямом методе ИФА. Обычно эти зависимости имеют, вид кривых с насыщением. Для проведения эксперимента выбираются разведения антисыворотки, лежащие в линейном диапазоне кривой. Для установления равновесной константы диссоциации комплекса Ar·At концентрацию антигена варьируют в диапазоне от 10-6 до 10-8 М. На рис. приведен график для определения Кл комплекса ПХ-Ат. Однако вычисленные этим методом значения констант диссоциации комплекса At •Ar являются эффективными, поскольку при выборе уравнения не учитывается влияние взаимодействия антител с антигеном, сорбированным на твердой фазе, на равновесие в растворе.
Экспериментально контроль влияния иммобилизованного антигена на равновесие в реакции Ar-At в растворе осуществляется сравнением сигналов, полученных на стадии твердофазного ИФА в двух соседних рядах лунок. Для этого содержимое лунок одного ряда переносится во второй свободный, обработанный аналогично первому, после чего сравнивают значения сигналов. Если наблюдаемые различия не превышают 10%, то можно полагать, что влияние иммобилизованного антигена на равновесия Ar-At в растворе незначительно.
Более точная оценка общего случая с учетом влияния иммобилизованного антигена может быть дана в рамках модели связывания лиганда с несколькими независимыми центрами связывания:
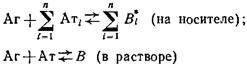
Если К* - константа связывания антител с иммобилизованным центром связывания, а,· - концентрация различных субпопуляций антител, связывающихся с иммобилизованным антигеном, то нетрудно показать, что в этом случае окончательное выражение уравнение Клотца будет иметь вид
![]()
Обозначим![]() как С. Параметр
С для реакций ряда антигенов был найден экспериментально, значение его не
превышает 2-2,5. При этом оценка С получена в предположении, что реакция
антител с иммобилизованным антигеном достигает равновесия. Кинетика этого
процесса представлена на рис., из которого видно, что время установления
равновесия значительно больше используемого в эксперименте при определении
константы. Поэтому полученное значение С является максимальным и
максимальная ошибка, которая допускается при определении Ku, составляет
200-250%.
как С. Параметр
С для реакций ряда антигенов был найден экспериментально, значение его не
превышает 2-2,5. При этом оценка С получена в предположении, что реакция
антител с иммобилизованным антигеном достигает равновесия. Кинетика этого
процесса представлена на рис., из которого видно, что время установления
равновесия значительно больше используемого в эксперименте при определении
константы. Поэтому полученное значение С является максимальным и
максимальная ошибка, которая допускается при определении Ku, составляет
200-250%.
Метод может быть использован для вычисления констант связывания как поликлональных, так и моноклональных антител.
© 2010 Интернет База Рефератов