
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Реферат: Процесс трансляции
Реферат: Процесс трансляции
ГОУВПО
"Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого
Министерства здравоохранения и социального развития Российской Федерации"
Кафедра биологической химии с курсом медицинской, фармацевтической и токсикологической химии
Реферат
Трансляция
Выполнила: студентка 206 группы
Мамрукова О.В.
Проверила: ст. преподаватель
Климова А.Д.
Красноярск
2010
Содержание
Введение
1. Генетический код: общие сведения
2. Белоксинтезирующая система
3. Этапы синтеза полипептидной цепи
4. Процессы трансляции
5. Регуляция биосинтеза белка на этапе трансляции
Заключение
Список литературы
Приложения
Введение
Живой организм характеризуется высшей степенью упорядоченности составляющих его ингредиентов и уникальной структурной организацией, обеспечивающей как его фенотипические признаки, так и многообразие биологических функций. В этом структурно-функциональном единстве организмов, составляющем сущность жизни, белки играют важнейшую роль, не заменяемую другими органическими соединениями.
Одной из задач современной биологии и ее новейших разделов – молекулярной биологии, биоорганической химии, физико-химической биологии – является расшифровка механизмов синтеза молекулы белка, содержащей сотни, а иногда и тысячи остатков аминокислот. Механизм синтеза должен обладать точной кодирующей системой, которая автоматически программирует включение каждого аминокислотного остатка в определенное место полипептидной цепи Кодирующая система определяет первичную структуру, а вторичная и третичная структуры белковой молекулы определяются физико-химическими свойствами и химическим строением аминокислот.
В современные представления о механизме синтеза белка большой вклад внесли советские биохимики. Так, в лаборатории А. Е. Браунштейна было впервые указано на участие АТФ в синтезе квазипептидных связей. В. Н. Ореховичем еще 50-е годы было показано, что перенос аминоцильных или пептидильных группировок на NH2 группу аминокислот может осуществляться не только с амидной или пептидной, но и со сложноэфирной связи. Как будет показано ниже, именно этот механизм лежит в основе реакции транспептидирования в 50S рибосоме в стадии элонгации синтеза белка.
Значительный вклад в современные представления о месте, факторах и механизме синтеза белка внесли исследования Т. Касперсона, П. Берга, П. Замечника, С. Очоа, А. А. Баева, А. С. Спирина и др.
1. Генетический код: общие сведения
Перевод информации, заключенной в полинуклеотидной последовательности мРНК, в аминокислотную последовательность белка требует определенного способа кодирования или шифрования, т.е. существования определенного закона, по которому чередование четырех нуклеотидов в мРНК задаёт специфическую последовательность аминокислот в белке.
Необходимость кодирования структуры белков в линейной последовательности нуклеотидов мРНК и ДНК продиктована тем, что в ходе трансляции:
- нет соответствия между числом мономеров в матрице мРНК и продукте – синтезируемом белке;
- отсутствует структурное сходство между мономерами РНК и белка.
Это исключает комплементарное взаимодействие между матрицей и продуктом – принцип, по которому осуществляется построение новых молекул ДНК и РНК в ходе репликации и транскрипции.
Отсюда становиться ясным, что должен существовать "словарь", позволяющий выяснить, какая последовательность нуклеотидов мРНК обеспечивает включение в белок аминокислот в заданной последовательности. Этот "словарь" получил название генетического, биологического, нуклеотидного, или аминокислотного кода. Генетический код – основан на использовании алфавита, состоящего всего из четырех букв: A, G, T, C.
Но каким же образом передается информация от РНК, содержащей всего четыре нуклеотида, на белок, содержащий 20 различных аминокислот? Если бы каждый нуклеотид передавал информацию на синтез одной аминокислоты, то всего кодировалось бы 4 аминокислоты. Не может код состоять из двух нуклеотидов, так как в этом случае можно было бы охватить не более 16 аминокислот (42=16). Работами М. Ниренберга и соавторов было установлено, что для кодирования одной аминокислоты требуется не менее трех последовательно расположенных нуклеотидов, называемых кодонами или триплетами. При этом между отдельными кодонами нет промежутков, и информация записана слитно, без знаков препинания. Число сочетаний 43 дает основание полагать, что 20 аминокислот кодируется 64 кодонами. Экспериментально доказано, что таких кодонов меньше, всего 61, а 3 остальных UAA, UAG и UGA не несут в себе информации и первоначально были названы бессмысленными, или нонсенс-кодонами. Однако в дальнейшем было показано, что эти триплеты сигнализируют о завершении трансляции, и поэтому их стали называть терминирующими, или стоп-кодонами.
Кодоны мРНК и триплеты нуклеотидов в кодирующей нити ДНК с направлением от 5¢ к 3¢ - концу имеют одинаковую последовательность азотистых оснований, за исключением того, что в ДНК вместо урацила, характерного для мРНК, стоит тимин.
Выявлена также интересная особенность взаимодействия кодона с антикодоном. Оказалось, что первое и второе азотистые основания кодона образуют более прочные связи с комплементарными основаниями антикодона. Что же касается третьего основания, то эта связь менее прочная, более того, основание кодона может спариваться с другим, не комплементарным основанием антикодона. Этот феномен называют механизмом неоднозначного соответствия или качания. В соответствии с этим урацил антикодона может взаимодействовать не только в аденином, но и гуанином кодона. Гуанин антикодона способен связываться не только с цитозином, но и с урацилом кодона. Это указывает на возможность нескольких кодонов кодировать одну и туже аминокислоту. И действительно было установлено, что ряд аминокислот кодируется двумя и более антикодонами (Приложение 1, табл. 1). Из таблицы видно, что только две аминокислоты - метионин и триптофан – кодируются при помощи одного кодона. Тот факт, что одной и той же аминокислоте соответствует несколько кодонов, называется вырожденностью генетического кода. Биологический смысл этого явления связан, по-видимому, с возможностью более быстрого отделения тРНК от мРНК, что очень важно для процесса белкового синтеза.
На основании вышеизложенного можно суммировать основные свойства генетического кода:
-триплетность — одну аминокислоту кодируют три нуклеотида (триплет или кодон);
-непрерывность — у всех организмов код линейный, однонаправленный и непрерывный;
-неперекрываемость — один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов;
-специфичность — определённый кодон соответствует только одной аминокислоте;
-вырожденность (избыточность) одной и той же аминокислоте может соответствовать несколько кодонов;
-универсальность — генетический код работает одинаково у всех живых организмов.
До последнего времени генетический код считался абсолютно универсальным. Теперь стало известно, что набор тРНК в митохондриях клеток как низших, так и высших эукариотических организмов, считывает 4 кодона иначе, чем тРНК-молекулы цитоплазмы этих же или любых других клеток. В митохондриях необходимы только 22 вида тРНК, в то время как для синтеза белка в цитоплазме используется весь набор, включающий 31 вид тРНК-молекул. И все же, за вышеупомянутым исключением, генетический код – универсален.
До расшифровки генетического кода было невозможно понять механизм синтеза белка и объяснить происхождение мутаций. Открытие генетического кода позволило ответить на вопрос о том, как связаны между собой дефекты определенных белков человека и наследственные заболевания. Кроме того, благодаря расшифровке генетического кода были созданы необходимые предпосылки для диагностики и лечения таких заболеваний.
2. Белоксинтезирующая система
Клетки должны обладать специальными механизмами для точного, аккуратного и эффективного перевода последовательности мРНК в соответствующую последовательность аминокислот кодируемого белка. Трансляция (биосинтез белков с использованием мРНК в качестве матрицы) осуществляется в клетках при помощи сложной белок-синтезирующей системы. Отдельные компоненты этой системы ассоциируют в единую структуру по мере ее функционирования и разобщаются по окончанию синтеза. В состав белок-синтезирующей системы входят следующие структуры:
· Рибосомы;
· матричная РНК;
· транспортная РНК;
· белковые факторы и ферменты инициации, элонгации и терминации трансляции;
· набор аминокислот;
· набор аминоацил-тРНК-синтетаз, образующих аминоацил-тРНК;
· макроэрги АТФ и ГТФ;
· ионы Mg 2+, Ca2+, K+, NH4+.
Рибосомы
Рибосомы представляют собой рибонуклеопротеиновые образования — своеобразные "фабрики", на которых идёт сборка аминокислот в белки. Обычно рибосомы характеризуют по скорости их седиментации в центрифужном поле, которая количественно выражается константой седиментации s, выражаемой в единицах Сведберга S. Эукариотические рибосомы имеют константу седиментации 80S и состоят из 40S (малой) и 60S (большой) субъединиц. Каждая субъединица включает рРНК и белки. В 40S субъединицу входит рРНК с константой седиментации 18S и около 30—40 белков. В 60S субъединице обнаружено 3 вида рРНК: 5S, 5,8S и 28S и около 50 различных белков.
Белки входят в состав субъединиц рибосомы в количестве одной копии и выполняют структурную функцию, обеспечивая взаимодействие между мРНК и тРНК, связанными с аминокислотой или пептидом.
В присутствии мРНК 40S и 60S субъединиц объединяются с образованием полной рибосомы, масса которой примерно в 650 раз больше массы молекулы гемоглобина.
В рибосоме есть 2 центра для присоединений молекул тРНК: аминоацильный (А) и пептидильный (Р) центры, в образовании которым участвуют обе субъединицы. Вместе центры А и Р включают участок мРНК, равный 2 кодонам. В ходе трансляции центр А связываем аа-тРНК, строение которой определяет кодон, находящийся в области этого центра. В струкЯ туре этого кодона зашифрована природа аминокислоты, которая будет включена в растущую полипептидную цепь. Центр Р занимает пептидил-тРНК, т.е. тРНК, связанная с пептидной цепочкой, которая уже синтезирована.
У эукариотов различают рибосомы 2 типом "свободные", обнаруживаемые в цитоплазма клеток, и связанные с эндоплазматическим ретикулумом (ЭР). Рибосомы, ассоциированнье с ЭР, ответственны за синтез белков "на экспорт", которые выходят в плазму крови и участвуют в обновлении белков ЭР; мембраны аппарата Гольджи, митохондрий или лизосом.
Митохондрии содержат свой набор рибосом. Митохондриальные рибосомы мельче, чем рибосомы эукариотов, прокариотов и имеют константу седиментации 55S. Они также состояв из двух субъединиц, но отличаются от эукаририотических рибосом количеством и составом РНК и белков.
Матричная РНК
Содержит информацию о структуре синтезируемого белка и используется в качестве матрицы.
Опыты Ниренберга свидетельствуют о том, что не рибосома и не рРНК являются матрицей, на которой синтезируются специфические белки, эту роль выполняют поступающие извне матричные РНК. ДНК предает информацию на РНК, которая синтезируется в ядре и затем поступает в цитоплазму. Здесь РНК выполняет матричную функцию для синтеза специфической белковой молекулы. Матричная гипотеза синтеза белка, как и других полимерных молекул ДНК и РНК, получила в настоящее время полное подтверждение. Ее правильность была доказана в экспериментах, которые обеспечивали точное воспроизведение первичной структуры полимерных молекул; причем этот синтез в отличии от беспорядочного химического синтеза отличался не только высокой скоростью и специфичностью, но и направленностью самого процесса, в строгом соответствии с программой, записанной в линейной последовательности молекулы матрицы.
Транспортная РНК
На долю тРНК приходится около 10-15% общего количества клеточной РНК. К настоящему времени открыто более 60 различных тРНК. тРНК называют "адапторные молекулы", т.к. к акцепторному концу этих молекул может быть присоединена определенная аминокислота, а с помощью антикодона они узнают специфический кодон на мРНК. Для каждой аминокислоты в клетке имеется по крайней мере одна специфическая РНК (для ряда аминокислот открыто более одной, в частности для серина – 5 разных тРНК, для лизина и глицина – по 4 разных тРНК, хотя и в этом случае каждая тРНК связана со специфической аминоацил–тРНК-синтетазой). Молекулярная масса большинства тРНК колеблется от 24000 до 29000 Да. Они содержат от 75 до 85 нуклеотидов. Аминокислоты присоединяются к свободной 3¢-ОН-группе концевого мононуклеотида, представленного во всех тРНК АМФ, путем образования эфирной связи. Интересно, что почти все тРНК обладают не только индивидуально сходными функциями, но и очень похожей трехмерной структурой.
Установлена первичная структура почти всех 60 открытых тРНК. Общей для тРНК оказалась также нативная конформация, установленная методом рентгеноструктурного анализа и названная первоначально названная конформацией клеверного листа; на самом деле эта конформация имеет неправильную, Г-образную, форму.
Определение структуры тРНК позволило выявить ряд отличительных участков; так, 3¢-гидроксильном конце располагается одинаковая для всех тРНК последовательность триплета ЦЦА – ОН, к которой присоединяется посредством эфирной связи специфическая аминокислота. Связывание в основном происходит через 3¢-ОН-группу концевого аденилового нуклеотида, хотя получены доказательства возможности присоединения аминокислоты и через 2¢-ОН-группу. Тимидин-псевдоуридин-цитидиловая петля, по-видимому, обеспечивает связывание аминоацил-тРНК с поверхностью рибосомы. Имеется кроме того, добавочная петля, состав которой варьирует у разных типов молекул тРНК; ее назначение неизвестно. Дигидроуридиловая петля, с другой стороны, оказалась необходимой как сайт (место) для узнавания специфическим ферментом – аминоацил-тРНК-синтетазой. Имеется также антикодоновая петля, несущая триплет, названный антикодоном, и расположенная на противоположной стороне от того конца, куда присоединяется аминокислота. Антикодон является антипараллельными в своей комплементарности.
Белковые факторы
В каждой стадии белкового синтеза на рибосоме: инициации, элонгации и терминации участвует разный набор внерибосомных белковый факторов:
- инициации elF1, elF2;
- элонгации FF1, FF2;
- терминации RF1, RF2, RF3;
- другие.
Эти белки связываются с рибосомой или её субъединицами на определённых стадиях процесса и стабилизируют или облегчают функционирование белоксинтезирующей машины.
Аминокислоты
Все 20 аминокислот, входящих в структуру белков организма человека, должны присутствовать в достаточном количестве. Это требование прежде всего относится к незаменимым (т. е. не синтезирующимся в организме) аминокислотам, так как недостаточное снабжение клетки хотя бы одной незаменимой аминокислотой приводит к снижению, а иногда и полной остановке синтеза белка на кодоне, требующем включения этой аминокислоты в белок.
Аминоацил –тРНК синтетазы
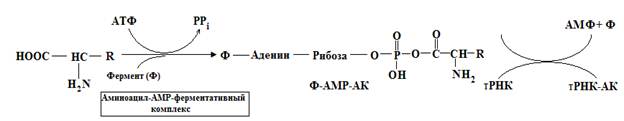
Так как у нуклеиновых кислот нет какого-либо специального сродства к боковым цепям аминокислот, взаимное узнавание должно происходить с помощью специальной молекулы белка, способной выявлять одновременно и определенную тРНК-молекулу, и соответствующую аминокислоту. Для подобного узнавания и правильного присоединения соответствующей аминокислоты к молекуле тРНК должно существовать по крайней мере 20 специфичных ферментов. Процесс узнавания и присоединения происходит в два этапа и катализируется ферментом – уникальным для каждой из 20 аминокислот, принадлежащим к классу аминоацил-тРНК-синтетаз. Этот фермент образует активированный промежуточный аминоацил-АМР-ферментативный коплекс, который специфически узнает соответствующую молекулу тРНК и переносит аминокислотный остаток на 3¢-OH группу концевого аденозина. Аминокислота остается присоединенной эфирной связью к тРНК вплоть до включения в определенное положение растущей полипептидной цепи предшественника белка.
АТФ и ГТФ как источники энергии
На включение одной аминокислоты в растущую полипептидную цепь клетка затрачивает 4 макроэргические связи: 2 из АТФ в ходе реакции, катализируемой аа-тРНК синтетазой (в процессе активации аминокислот АТФ расщепляется на АМФ и пирофосфат), и 2 молекулы ГТФ: одна используется на связывание аминоацил-тРНК в А-центре рибосомы, а вторая затрачивается на стадию транслокации. К этому следует добавить использование ещё двух макроэргических связей молекул: АТФ и ГТФ на инициацию и терминацию синтеза полипептидной цепи.
3. Этапы синтеза полипептидной цепи
Синтез белка представляет собой циклический многоступенчатый энергозависимый процесс, в котором свободные аминокислоты полимеризуется в генетически детерминированную последовательность с образованием полипептидов. Система белкового синтеза, точнее система трансляции, которая использует генетическую информацию, транскрибированную в мРНК, для синтеза полипептидной цепи с определенной первичной структурой, включает около 200 типов макромолекул – белков и нуклеиновых кислот. Среди них около 100 макромолекул, участвующих в активировании аминокислот и их переносе на рибосомы, более 60 макромолекул, входящих в состав 70S или 80S рибосом, и около 10S макромолекул, принимающих непосредственное участие в системе трансляции. Белковый синтез, или процесс трансляции, может быть условно разделен на 2 этапа: активирование аминокислот и собственно процесс трансляции.
Второй этап матричного синтеза белка, собственно трансляцию, протекающей в рибосоме, условно делят на три стадии: инициации, элонгации и терминации.
Активирование аминокислот
Большая часть аминокислот в цитоплазме клеток находиться не в свободном состоянии, а в виде аминоацил-тРНК. Это предохраняет аминокислоты от метаболических превращений и способствует сохранению набора аминокислот для синтеза белка. Образованию комплекса аминокислота-тРНК предшествует активация аминокислоты и нахождение соответствующей тРНК (рекогниция). Это происходит под действием фермента аминоацил-тРНК-синтетазы, или АРС-азы. Эти ферменты имеют два активных центра, один из которых соответствует определенной тРНК, а другой строго специфичен соответствующей аминокислоте. Таким образом, в клетке должно быть не менее 20 АРС-аз, хотя фактически их несколько больше. Образование аминоацил-тРНК происходит в два этапа, первым из которых является взаимодействие АК с АТФ:
![]()
Аминоациладенилат (АК~АМФ) остается в комплексе с АРС-азой до присоединения ко второму активному центру фермента тРНК. При взаимодействие комплекса (АК~АМФ)-АРС-аза с тРНК образуется аминоацил-тРНК, при этом выделяется свободный фермент и АМФ:
![]()
4. Процессы трансляции
Второй этап матричного синтеза белка, собственно трансляцию, протекающую в рибосоме, условно делят на три стадии: инициацию, элонгацию и терминацию.
Инициация
В ходе инициации происходит образованиe комплекса, включающего Мет-тРНКiмет, мРНК и рибосому, где—тРНКiмет инициирующая метиониновая тРНК. В этом процессе участвуют не менее 10 факторов инициации, которые обозначают как elF (от англ. eukaryotic initiation factors) с указанием номера и буквы. У большинства мРНК-молекул эукариот 5¢-конец "кэпирован". Кэп представляет собой остаток метилгуанозилтрифосфата и, возможно, участвует в связывание РНК-молекул с 40S-субъединицей рибосомы. Первоначально 40S субъединица рибосомы соединяется с фактором инициации, который препятствует её связыванию с 60S субъединицей, но стимулирует объединение с тройным комплексом, включающим Мет-тРНКiмет, eIF-2 и ГТФ (Приложение 2 рис.1). Затем этот теперь уже более сложный комплекс связывается с 5'-концом мРНК при участии нескольких elF. Один из факторов инициации (elF-4F) узнаёт и присоединяется к участку "кэп" на молекуле мРНК, поэтому он получил название кэпсвязывающего белка. Прикрепившись к мРНК, 40S субъединица начинает скользить по некодирующей части мРНК до тех пор, пока не достигнет инициирующего кодона AUG кодирующей нуклеотидной последовательности. Скольжение 40S субъединицы по мРНК сопровождается гидролизом АТФ, энергия которого затрачивается на преодоление участков спирализации в нетранслируемой части мРНК. В эукариотических клеках некодирующие участки мРНК имеют разную длину, но обычно от 40 до 80 нуклеотидов, хотя встречаются области с протяжённостью более 700 нуклеотидов.
Достигнув начала кодирующей последовательности мРНК, 40S субъединица останавливается и связывается с другими факторами инициации, ускоряющими присоединение 60S субъединицы и образование 80S рибосомы за счёт гидролиза ГТФ до ГДФ и неорганического фосфата. При образовании полной рибосомы формируются два центра трансляции: донорный (пептидильный, P-центр) и акцепторный (аминоацильный, А-центр).
В Р-центре оказывается AUG-кодон мРНК с присоединённым к нему Мет-тРНКiмет, аминоацильный участок содержит аминоацил-тРНК, соединенную с соответствующим кодоном мРНК.
Элонгация
Самый продолжительный этап белкового синтеза — элонгация, в ходе которого рибосома с помощью аа-тРНК последовательно "читает" мРНК в виде триплетов нуклеотидов, следующих за инициирующим кодоном в направлении от 5' к З'-концу, наращивая полипептидную цепочку за счёт последовательного присоединения аминокислот. Присоединение соответствующей аминоацил-тРНК в А-участке требует точного узнавания кодона. Фактор элонгации EF1 образует комплекс с ГТФ и молекулой аминоацил-тРНК. Благодаря этому аминоацил-тРНК может присоединиться к рибосоме. При этом произойдет высвобождение комплекса EF1-ГДФ и фосфата (приложение 2, рис. 2). Комплекс EF1-ГДФ затем вновь превращается в EF1-ГТФ при участии других свободных белковых факторов и ГТФ.
a-Аминогруппа новой амино-ацил-тРНК в участке А осуществляет нуклеофильную атаку этерефицированной карбоксильной группы пептидил-тРНК, занимающей P-участок. Эта реакция катализируется пептидилтрансферазой – белковым компонентом, входящим в состав 60S-рибосомной субъединицы.
После удаления пептидильного остатка с тРНК в Р-участке свободная молекула тРНК быстро покидает P-участок. Комплекс ГТФ с EF2 участвует в процессе транслокации новообраованной пептидил-тРНК из А-участка в Р-участок. При этом происходит гидролиз ГТФ, используемого в качестве кофактора EF2, до ГДФ и фосфата (рис.3). В результате транслокации вновь сформированная пептидил-тРНК и соответствующий ей кодон переходят в Р-участок, освобождая А-участок для нового цикла узнавания следующего кодона соответствующей молекулой аминоацил-тРНК и элонгации.
Терминация
Терминация представляет собой завершение синтеза полипептидной цепи и освобождение ее от рибосомы (рис. 4). После многих циклов элонгации, в результате которых синтезируется полипептидная цепь белка, в А-участоке появляется терминирующий или нонсенс-кодон. В норме отсутствуют молекулы тРНК, способные узнавать нонсенс-кодоны. Появление в А-участке терминирующего кодона распознается так называемыми факторами высвобождения (R-факторами). RА при участии ГТФ и пептидилтрансферазы обеспечивают гидролиз связи между полипептидом и молекулой тРНК, занимающей P-участок. После гидролиза и высвобождения синтезируемого полипептида и тРНК 80S-рибосома диссоциирует на 40S- и 60S-субъединицы.
Одну и туже цепь мРНК могут транслировать одновременно множество рибосом. Рибосомы, расположенные на одной молекуле мРНК, образуют полисому.
5. Регуляция биосинтеза белка на этапе трансляции
Лимитирующей стадией процесса трансляции является ее инициация. Наиболее подробно описан процесс изменения скорости инициации трансляции в результате фосфорилирования фактора инициации IF2. Реакция катализируется ферментом IF2-киназой, причем присоединение фосфатной группы инактивирует фактор инициации. Этот феномен был изучен на примере синтеза гемоглобина в ретикулоцитах. Оказалось, что активация IF2-киназы происходит за счет ее фосфорилирования цАМФ-зависимой протеинкиназой. Взаимодействие этой протеинкиназы с цАМФ и ее активацию блокирует гем, выполняя тем самым негативный контроль синтеза гемоглобина.
К лекарственным веществам, эффективно влияющим на синтез белка, относятся антибиотики. Большинство антибиотиков противобактериального действия ингибируют процессы трансляции. Такие антибиотики, как норвалин и индомицин, препятствуют образованию аминоацил-тРНК; стрептомицин, неомицин, конвалин, ауринтрикарбоновая кислота ингибируют инициацию трансляции; тетрациклин и стрептомицин ингибируют элонгацию, препятствуя связыванию аминоацил-тРНК с А-центром рибосомы. Пептидилтрансферазная реакция блокируется пуромицином и хлорамфениколом, а транслокация – эритромицином и виомицином.
Заключение
Трансляция крайне важный процесс, и нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и, соответственно, изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально. Следует отметить, что организм располагает мощными механизмами защиты: подобные изменения генетического аппарата быстро распознаются специфическими ферментами рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полимераз и лигаз.
Список литературы
1. Биохимия человека в 2 томах, Т 2//Р. Марри 2009 г.
2. Биохимия// Комов В.П., 2004г.
3. Биологическая химия//Шапиро Я.С., 2004г.
4. Биохимия//Северин Е.С., 2005г.
5. Биологическая химия//Березов Т.Т., Коровкин Б.Ф., 1990 г.
Приложение 1
Таблица 1. Вырожденность кода аминокислот
| Аминокислота | Число кодонов | Аминокислота | Число кодонов |
|
Мет Трп |
1 | Иле | 3 |
|
Асн Асп Цис Глн Глу Гис Лиз Тир Фен |
2 |
Ала Гли Про Тре Вал |
4 |
|
Арг Сер Лей |
6 |
Таблица 2. Генетический код
| Первое основание | Второе основание | Третье основание | |||
| U |
U Фен Фен Лей Лей |
C Сер Сер Сер Сер |
A Тир Тир * * |
G Цис Цис * Три |
U С A G |
| C |
Лей Лей Лей Лей |
Про Про Про Про |
Гис Гис Глн Глн |
Арг Арг Арг Арг |
U С A G |
| A |
Иле Иле Мет Мет |
Тре Тре Тре Тре |
Асн Асн Лиз Лиз |
Сер Сер Арг Арг |
U С A G |
| G |
Вал Вал Вал Вал |
Ала Ала Ала Ала |
Асп Асп Глу Глу |
Гли Гли Гли Гли |
U С A G |
Приложение 2
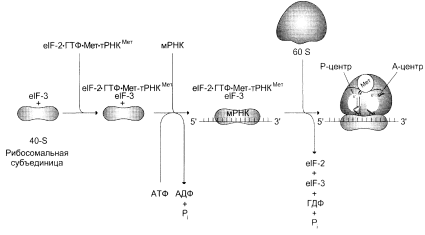
Рисунок 1
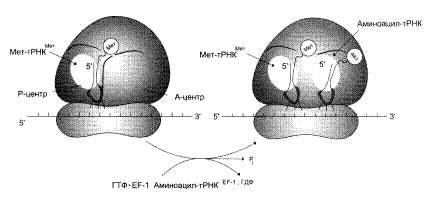
Рисунок 2
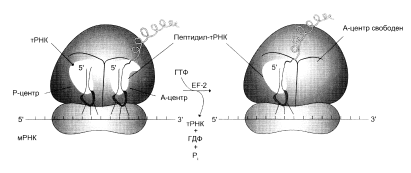
Рисунок 3
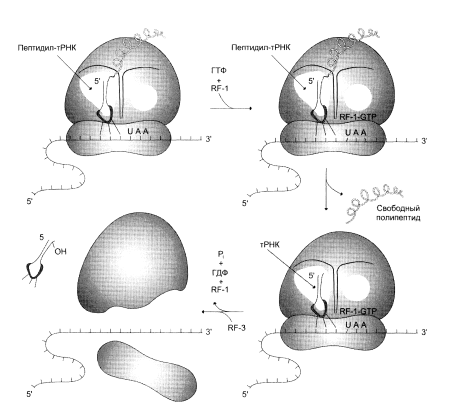
Рисунок 4
© 2010 Интернет База Рефератов