
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Шпаргалка: Характеристика общих свойств микроорганизмов
Шпаргалка: Характеристика общих свойств микроорганизмов
1. Характеристика схожести и отличия прокариотических и эукариотических клетокОбоснование того, что прокариотный и эукариотный типы клеточной организации являются наиболее существенной границей, разделяющей все клеточные формы жизни, связано с работами Р. Стейниера (R. Stanier, 1916—1982) и К. ван Ниля, относящимися к 60-м гг. Поясним разницу между прокариотами и эукариотами. Клетка — это кусочек цитоплазмы, отграниченный мембраной. Последняя под электронным микроскопом имеет характерную ультраструктуру: два электронно-плотных слоя каждый толщиной 2,5—3,0 нм, разделенных электронно-прозрачным промежутком. Такие мембраны получили название элементарных. Обязательными химическими компонентами каждой клетки являются два вида нуклеиновых кислот (ДНК и РНК), белки, липиды, углеводы. Цитоплазма и элементарная мембрана, окружающая ее, — непременные и обязательные структурные элементы клетки. Это то, что лежит в основе строения всех без исключения клеток. Изучение тонкой структуры выявило существенные различия в строении клеток прокариот (бактерий и цианобактерий) и эукариот (остальные макро- и микроорганизмы).
Прокариотная клетка отличается тем, что имеет одну внутреннюю полость, образуемую элементарной мембраной, называемой клеточной, или цитоплазматической (ЦПМ). У подавляющего большинства прокариот ЦПМ — единственная мембрана, обнаруживаемая в клетке. В эукариотных клетках в отличие от прокариотных есть вторичные полости. Ядерная мембрана, отграничивающая ДНК от остальной цитоплазмы, формирует вторичную полость. Наружные мембраны хлоропластов и митохондрий, окружающие заключенные в них функционально специализированные мембраны, играют аналогичную роль. Клеточные структуры, ограниченные элементарными мембранами и выполняющие в клетке определенные функции, получили название органелл. Ядро, митохондрий, хлоропласты — это клеточные органеллы. В эукариотных клетках помимо перечисленных выше есть и другие органеллы.
В клетках прокариот органеллы, типичные для эукариот, отсутствуют. Ядерная ДНК у них не отделена от цитоплазмы мембраной. В цитоплазме находятся функционально специализированные структуры, но они не изолированы от цитоплазмы с помощью мембран и, следовательно, не образуют замкнутых полостей. Эти структуры могут быть сформированы и мембранами, но последние не замкнуты и, как правило, обнаруживают тесную связь с ЦПМ, являясь результатом ее локального внутриклеточного разрастания. В клетках прокариот есть также образования, окруженные особой мембраной, имеющей иное по сравнению с элементарной строение и химический состав.
Таким образом, основное различие между двумя типами клеток — существование в эукариотной клетке вторичных полостей, сформированных с участием элементарных мембран. Сопоставление некоторых черт клеточной организации прокариотных и эукариотных организмов представлено в таблица 1. Сопоставление некоторых черт прокариотной и эукариотной клеточной организации:
| Признак | Прокариотная клетка | Эукариотная клетка |
| Организация генетического материала | нуклеоид (ДНК не отделена от цитоплазмы мембраной), состоящий из одной хромосомы; митоз отсутствует | ядро (ДНК отделена от цитоплазмы ядерной оболочкой), содержащее больше одной хромосомы; деление ядра путем митоза |
| Локализация ДНК | в нуклеоиде и плазмидах, не ограниченных элементарной мембраной | в ядре и некоторых органеллах |
| Цитоплазматические органеллы | отсутствуют | имеются |
| Рибосомы в цитоплазме | 70S-типа | 80S-типа |
| Цитоплазматические органеллы | отсутствуют | имеются |
| Движение цитоплазмы | отсутствует | часто обнаруживается |
| Клеточная стенка (там, где она имеется) | в большинстве случаев содержит пептидогликан | пептидогликан отсутствует |
| Жгутики | нить жгутика построена из белковых субъединиц, образующих спираль | каждый жгутик содержит набор микротрубочек, собранны в группы: 2·9-2 |
В связи с тем что прокариотная и эукариотная организация клеток принципиально различна, было предложено только на основании этого признака выделить все прокариоты в особое царство. Р. Меррей (R. Murray) в 1968 г. предложил все клеточные организмы разделить на две группы по ТИПУ их клеточной организации: царство Prokaryotae, куда вошли все организмы с прокариотным строением клетки, н царство Eukaryotae, куда включены все высшие протисты, растения и животные.
Р. Виттэкер (R. Whittaker) предложил схему, по которой все живые организмы, имеющие клеточное строение, представлены разделенными на пять царств (рис. 2). Такая система классификации живого мира отражает три основных уровня его клеточной организации: Monera включает прокариотные организмы, находящиеся на самом примитивном уровне клеточной организации; Protista — микроскопические, в большинстве своем одноклеточные, недифференцированные формы жизни, сформировавшиеся в результате качественного скачка в процессе эволюции, приведшего к возникновению эукариотных клеток; многоклеточные эукариоты представлены в свою очередь тремя царствами Plantae, Fungi и Animalia.
Три последние таксономические группы различаются по способу питания: фототрофный тип питания за счет процесса фотосинтеза характерен для растений (Plantae): грибы (Fungi) в основном характеризуются осмотрофным типом питания, т. е. питанием растворенными органическими веществами; животные (Animalia) осуществляют голозойное питание, заключающееся в захватывании и переваривании твердой пищи. Способы питания, специфические для растений и грибов, возникли в процессе эволюции на уровне Monera. На уровне Protista они получили свое дальнейшее развитие; здесь же сформировался третий тип питания — голозойный.
Не берясь судить о целесообразности деления живой природы на пять или шесть царств, можно с определенностью утверждать, что обособление прокариотных микроорганизмов в отдельное царство Prokaryotae правомерно, поскольку основано на принципиальных различиях в структуре прокариотных и эукариотных клеток, т. е. тех единиц, из которых построены все клеточные формы жизни.
2. Характеристика морфологических и структурных признаков бактерий Firmicutes и gracilicutes
Firmicutes - тип бактерий, большинство из которых грамм-положительные. Некоторые (класс Mollicutes), совсем не имеют клеточной стенки и не красятся за Граммом, но не имеют и внешней мембраны, найденной в других грамм-отрицательных формах. Сначала к Firmicutes включали всех грамм-положительных бактерий, но сейчас они ограничиваются основной группой связанных форм, так называемой группой низкого содержимого G+C, в отличие от Actinobacteria. Они имеют круглые клетки, которые называют коками (хотя некоторые представители имеют палочковидные и спиральные формы).
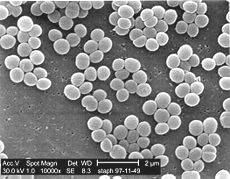
Електронна мікрофотографія колонії
Staphylococcus aureus
Много Firmicutes образовывают эндоспоры, которые есть очень стойкими к высушиванию и могут выдерживать экстремальные условия. Они найдены в разных окружающих средах, некоторые из них - известные патогены. Члены одной семьи, Heliobacteriaceae, получают энергию через фотосинтез.
Группа традиционно делилась на Clostridia (преимущественно анаэробы), Bacilli (облигатные или факультативные аэробы), и Mollicutes. На молекулярных деревьях первые две группы часто показываются как парафилетические или полифилетические к их основным родам, Clostridium и Bacillus, хотя поддержка этих данных слабая. Возможно, позднее эти группы будут пересмотрены.
Наиболее известные роды Firmicutes включают:
Bacilli, ряд Bacillales
Bacillus
Listeria
Staphylococcus
Bacilli, ряд Lactobacillales
Enterococcus
Lactobacillus
Lactococcus
Leuconostoc
Streptococcus
Clostridia
Acetobacterium
Clostridium
Eubacterium
Heliobacterium
Heliospirillum
Sporomusa
Mollicutes
Mycoplasma
Spiroplasma
Ureaplasma
Erysipelothrix
Способность образовывать более или менее терморезистентные споры, за немногими исключениями, ограничивается группой палочек, большинство из которых имеет перитрихально расположенные жгутики. Это грам-положительные бактерии. Аэробные и факультативно-анаэробные палочки сведены в роды Bacillus, Sporolactobacillus и Sporosarcina, а анаэробные роды Clostridium и Desulfotomaculum. Многие спорообразую-шие виды хорошо известны благодаря своим биохимическим особенностям. Здесь будут рассмотрены лишь некоторые представители больших родов Bacillus и Clostridium.
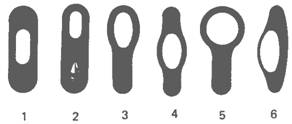
Рис. 2. Схематическое изображение типичных форм спорообразующих клеток. 1 -центрально расположенная спора, которая не увеличивает размера материнской клетки (Bacillus megaterium); 2-терминальная спора, не увеличивающая размеров материнской клетки (Bacillus thuringiensis), с белковыми включениями; 3 - терминальная спора, расширившая материнскую клетку булавовидно (Bacillus macerans); 4-центральная спора, придающая материнской клетке веретенообразную (клостридиеподобную) форму (Bacillus polymyxa); 5-круглая терминальная спора, придавшая материнской клетке форму барабанной палочки (плектри-диальную форму) (Bacillus sphaericus); 6-латеральная спора; материнская клетка увеличилась в размерах, приняв форму веретена (Bacillus laterosporus).
Аэробные спорообразующие бактерии. Бактерии этого типа обитают в почве. Многие бациллы образуют цепочки клеток или нити. По форме спор и материнских клеток (рис. 3.6) бациллы могут быть разделены на три группы:
(I) Споры овальные или цилиндрические, не толще материнской клетки. Таковы споры большинства бацилл (В. megaterium, В. cereus, В. subtilis, В. licheniformis, B. anthracis, B. thuringiensis).
(II) Овальные споры шире материнской клетки; они «раздувают» клетку изнутри в ходе споруляции (В. polymyxa, В. macerans, В. stearothermophilus, В. circulans).
(III) Почти круглая спора в набухшем конце материнской клетки (В. pasteurii).
I. Bacillus megaterium с клетками величиной 2x5 мкм является гигантом среди эубактерий. Несколько меньше В. cereus; к этому виду теперь причисляют также вариант, получивший название «mycoides» за грибовидный рост на поверхности агара (В. cereus var. mycoides). Существуют «право- и левозакрученные» штаммы, но общий вид колоний очень типичен. В близком родстве с В. cereus находятся возбудитель сибирской язвы В. anthracis, который не имеет жгутиков и окружен капсулой из глутаминовой кислоты, и патогенная для насекомых бактерия В. thuringiensis. Вид Bacillus subtilis, получивший название «сенной палочки» (так как накопительные культуры получают из сенного экстракта), а также В. licheniformis образуют полипептидные антибиотики. Вторая из названных бацилл способна расти, получая энергию не только за счет кислородного дыхания, но также за счет брожения и анаэробного нитратного дыхания.
П. Бактерия В. polymyxa (ранее называвшаяся В. asterosporus) получила нынешнее свое название из-за того, что образует большое количество слизи (а также боченкообразные, в поперечном сечении звездчатые споры). Как и В. licheniformis, она образует 2,3-бутандиол. В. stеarothermophilus - выраженный термофил (температурный оптимум для роста 50-65°С).
III. Вид В. pasteurii известен как классический пример бациллы, разлагающей мочевину; он конститутивно синтезирует уреазу, гидролизует мочевину до С02 и аммиака и приспособлен к высоким значениям рН. По своей физиологии с ним сходна Sporosarcina ureae, которая в морфологическом отношении, собственно, относится к сарцинам, но по основным физиологическим признакам должна быть отнесена к бациллам (аэроб; образует терморезистентные споры, содержащие дипиколино-вую кислоту).
Анаэробные спорообразующие бактерии. Для роста этих бактерий кислород не нужен. Виды, объединенные в род Clostridium, как правило, не имеют цитохромов и каталазы. Из-за высокого содержания флавиновых ферментов многие клостридии при контакте с кислородом воздуха образуют перекись водорода, которая оказывает на их клетки токсическое действие. Ввиду того что сульфатредуцирующие бактерии, образующие споры, содержат протогеминовые пигменты, их выделили из рода Clostridium в новый род Desulfotomaculum (D. nitrificans, D. orientis, D. ruminis). У анаэробных спорообразующих бактерий спора обычно значительно шире, чем вегетативная клетка. Материнская клетка в зависимости от положения споры может иметь различную форму.
Клостридии сбраживают большое число субстратов, включая полисахариды, белки, аминокислоты и пурины. По предпочитаемым субстратам можно различать сахаролитические клостридии (например, Clostridium butyricum, С. acetobutylicum, С. cellulosae-dissolvens), пептолитические клостридии (С. histolyticum, С. sporogenes, С. tetani, С. botulinum) и клостридии, разлагающие мочевую кислоту (С. acidi-urici). Продуктами брожения являются бутират, бутанол, ацетон, 2-пропанол и во многих случаях большие количества газа (Н2, С02). С. Pasteurianum и многие другие сахаролитические клостридии фиксируют молекулярный азот. С. aceticum превращает фруктозу или смесь С02 и молекулярного водорода в ацетат.
В качестве дополнения следует указать на Oscillospira guilliermondii--необычно крупную (5 х 100 мкм) анаэробную бактерию, разделяющуюся на клетки и образующую споры. Ее часто находят в слепой кишке морской свинки и в рубце жвачных.
Протеобактерии (proteobacteria) это одна из основных групп бактерий. Они насчитывают большое количество патогенов, таких как кишечная палочка (E.coli), сальмонела (Salmonella), вибрион (Vibrio), чумная палочка (Yersinia pestis), Helicobacter pylori и много других видов. Другие есть свободно живучими организмами, и насчитывают много бактерий, отвечающих за фиксацию азота. Как и для других бактерий, группа определяется по последовательностью рибосомной РНК (16S ррнк), и названная за именем греческого бога Протея (также как и один из родов бактерий сред протеобактерий), который мог изменять свою форму, в результате большого разнообразия форм, найденных в этой группе.
Все протеобактерии грамм-отрицательные, с внешней мембраной преимущественно построенной из полисахаридов. Многие из них двигаются применяя джгутики, но некоторые недвижимые, а другие викорустовують ворсинки или другие механизмы бактериального скольжения. Последние включают миксобактерий, уникальную группу бактерий, которые могут агрегуватися чтобы создать многоклеточные плодовые тела. Между протеобактерий также существует большое разнообразие типов метаболизма. Большинство членов являются факультативными или облигатними анаеробами и гетерофами, но также существуют множество исключения. Разные виды, не будучи родственными, превращают энергию света, применяя фотосинтез. Также среди протеобактерий существуют пурпурные бактерии, названные так за их красновату пигментацию.
Альфа-протеобактерии охватывают большинство фототрофных видов, но также несколько видов, метаболизующих C 1-вещества, симбиоты с растениями (ризобии) и животными, и группу опасных патогенов, Rickettsiaceae. Больше того, ученые считают, что предтечи митохондрий клеток эукариотов также возникли из этой группы.
Бета-протеобактерии содержат несколько групп аэробных или факультативных бактерий, которые часто очень разнообразные за своими возможностями метаболизма, крот того, хемолоитотрофные роды (т.е., окисляющий аммиак род Nitrosomonas) и фототрофов (роды Rhodocyclus и Rubrivivax). Многие из них найденные только в естественных образцах, например, видбросах и грунту. Этот класс содержит и некоторое количество патогенных видов: Neisseriaceae (gonorrhoe и meningoencephalitis) и виды рода Burkholderia.
Гамма-протеобактерии охватывают несколько клинично и научно важных групп of бактерий, таких как Enterobacteriaceae, Vibrionaceae и Pseudomonadaceae. Значительное число важных патогенив принадлежит к этому классу, т.е. Salmonella (вызывает энтерит и тиф), Yersinia (чума), Vibrio (холера), Pseudomonas aeruginosa (инфекции легких госпителизованых или клиничных пациентов с кистозным фиброзом).
Дельта-протеобактерии охватывают подраздел большей частью аэробных бактерий, бактерий образующих плодовые тела миксобактерии, и подраздел строго аэробных видов, который содержит большинство известных сульфат- (Desulfovibrio, Desulfobacter, Desulfococcus, Desulfonema, и т.п.) и серо-восстанавливающие бактерии (e.g. Desulfuromonas) и также несколько других анаеробных бактерии с другой физиологией (т.е. зализо-видновлюючи Geobacter и синтропичные виды: Pelobacter и Syntrophus).
Эпсилон-протеобактерии содержат лишь несколько видов, преимущественно вигнети и спиральные Wolinella, Helicobacter, и Campylobacter. Они все насиляють травный тракт животных и человека и служат как симбиоти (Wolinella в коровах) или патогени (Helicobacter в желудке, Campylobacter в двнадцатиперсний кишке).
Планктомицети - облигатно аэробные водные бактерии, найденные в образцах соленой и пресной воды. Они размножаются почкованием. По структуре, организмы этой группы яйцевидные и имеют структуру непепродуктивного конца, которая помогает им соединяться на протяжении почкования, так называемое стебель.
Организмы, которые принадлежат к этой группе не имеют пептидогликанив в клитиннии стенке. Пептидогликан - важный гетерополимер, присутствующий клеточных стенках большинства бактерий, который служат защитным компонентом. Вместе с тем стенки планктомицетов составлены с гликопротеинив богатых на глутамин. Планктомицети имеют внутренние структуры, более сложные, чем обычно ожидаются в прокариотах. Тогда как они не имеют клидинного ядра такой структуры как в эукариот, ядерный материал иногда может быть окружен в двойной мембране. В дополнение к этому нуклеоиду, эти бактерии содержат два других отдела, отделенных мембраной, пирреллюлозому или рибоплазму, которая содержит рибосомы и связанные белки, и свободный от рибосом парафоплазму (Glockner, 2003).
3. Характеристика общих свойств микроорганизмов
Микроорганизмы - это организмы, невидимые невооруженным глазом из-за их незначительных размеров. Этот критерий - единственный, который их объединяет. В остальном мир микроорганизмов еще более разнообразен, чем мир макроорганизмов. Согласно современной систематике, микроорганизмы относятся к трем царствам:
Vira - к ним относятся вирусы;
Eucariotae - к ним относятся простейшие и грибы;
Procariotae - к ним относятся истинные бактерии, риккетсии, хламидии, микоплазмы, спирохеты, актиномицеты.
Количество и жизнедеятельность микробов зависят от условий существования (питания, температуры, влажности).
По характеру питания микробы делятся на автотрофные, питающиеся минеральными веществами, и гетеротрофные, питающиеся готовыми органическими соединениями. Гетеротрофные микробы делятся на сапрофиты (метатрофы), разлагающие органические вещества в природе и вызывающие порчу пищевых продуктов, и паразиты (паратрофы), развивающиеся в теле других организмов и питающиеся сложными органическими веществами. К группе паразитов относятся разнообразные возбудители заболеваний человека и животных.
По типу дыхания микробы делятся на аэробы, развивающиеся только при доступе кислорода воздуха, и анаэробы, не нуждающиеся в кислороде воздуха. Анаэробные микробы подразделяются на облигатные, для которых кислород вреден, и факультативные, которые могут жить как при доступе воздуха, так и без него Температура является одним из наиболее важных факторов, влияющих на жизнедеятельность микробов.
По отношению к температуре микробы подразделяют на три группы мезофилы, психрофилы и термофилы.
Большинство микробов, находящихся в стадии активного размножения (вегетативная стадия), погибает при температуре около 70° С за 1—5 мин. Споры некоторых бактерий выдерживают кипячение в течение нескольких часов. Во влажной среде споры бактерий погибают при 120° С через 20—30 мин, а в с^хой — при 160—170° С через 1—2 ч Споры большинства дрожжей и плесеней менее устойчивы к воздействию высоких температур, чем споры бактерий и быстро погибают при нагревании до 65—80° С
Влияние температуры на жизнедеятельность микробов обусловливает возможность хранения пищевых продуктов (рыба, мясо и др.) при пониженных температурах, замедляющих размножение микробов и угнетающих деятельность ферментов. Наблюдения показывают, что количество микробов, погибших при замораживании продуктов, нередко достигает 80—90% от их первоначального содержания. Микроорганизмы, оставшиеся в живых, вначале инактивируются холодом, но при дальнейшем хранении охлажденного или замороженного продукта при температуре не ниже минус 8° С их жизнедеятельность постепенно восстанавливается Губительно действуют на микробы повторное замораживание и оттаивание продукта.
Большое влияние на жизнедеятельность микробов оказывает влажность среды. В результате высушивания продукта останавливается развитие многих видов содержащихся в нем микробов, так как при отсутствии воды они не могут питаться. Так, минимум содержания влаги в среде обитания для развития бактерии составляет 30%, а для многих плесеней около -13% . Споры некоторых плесневых грибов сохраняют способность к прорастанию при отсутствии влаги в течение нескольких лет.
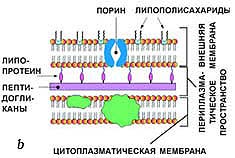
4. Особенности строения муреина у бактерий.
Опорный скелет бактериальной стенки тоже состоит в значительной степени из однородного полимера-пептидогликана муреина. Эта макромолекула - гетерополимер, построенный из цепочек, в которых чередуются остатки N-ацетилглюкозамина и N-ацетилмурамовой кислоты (N-ацетилглюкозаминлактата), соединенные между собой рЧ,4-глико-зидными связями.
Такие неразветвленные гетерополимерные цепи образуют основу муреина. Остатки мурамовой кислоты через лактильные группы соеди нены пептидной связью с аминокислотами. К типичным аминокислотам муреина относятся L-аланин, D-глутаминовая кислота, .мезодиаминопи-мелиновая кислота или L-лизин и D-аланин. Диаминокислоты мезо-(или LL-) диаминопимелиновая кислота и L-лизин играют большую роль в межмолекулярных сшивках, так как образуют пептидные связи с участием обеих аминогрупп и, таким образом, могут связать две гетерополимерные цепи между собой. Место диаминопимелино-вой кислоты или лизина могут занять орнитин или диаминомасляная кислота. Пептидными мостиками гетерополимерные цепи связаны между собой в мешкообразную гигантскую молекулу -муреиновый мешок.
Муреиновый мешок выполняет функцию опорного каркаса клеточной стенки. На нем откладываются и его инкрустируют различные другие вещества. По строению этого каркаса, а также по содержанию других веществ в клеточной стенке грам-положительные бактерии отличаются от грам-отрицательных.
Существуют 2 типа строения клеточной стенки:
· у бактерий первого типа пептидогликан муреин составляет до 90% массы клеточной стенки и образует многослойный (до 10 слоев) каркас, при этом он ковалентно связан с тейхоевыми кислотами. Такие бактерии при окраске по методу Грама прочно удерживают комплекс генцианового фиолетового и йода; они окрашиваются в сине-фиолетовый цвет и называютсяграмположителъными:
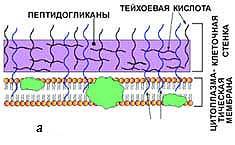
· у бактерий со вторым типом строения клеточной стенки поверх 2—3 слоев пептидогликана муреина располагается слой липополисахаридов. Эти бактерии при окраске по методу Грама неспособны прочно удерживать комплекс генцианового фиолетового и йода и соответственно обесцвечиваются спиртом, прокрашиваясь дополнительным красителем — фуксином — в розово-красный цвет. Они называются грамотрицательными.
5. Характеристика микроорганизмов по способам питания
Объединить типы конструктивного и энергетического метаболизма можно в следующей таблице:
| Способы существования живых организмов (матрица Львова) | ||||
| Источник энергии | Донор электрона | Источник углерода | Название способа существования | Представители |
| ОВР | Неорганические соединения | Углекислый газ | Хемолитоавтотрофия | Нитрифицирующие, тионовые, ацидофильные железобактерии |
| Органические соединения | Хемолитогетеротрофия | Метанообразующие архебактерии, водородные бактерии | ||
| Органические вещества | Углекислый газ | Хемоорганоавтотрофия | Факультативные метилотрофы, окисляющие муравьиную кислоту бактерии | |
| Органические соединения | Хемоорганогетеротрофия | Большинство прокариот, из эукариот: животные, грибы, человек | ||
| Свет | Неорганические соединения | Углекислый газ | Фотолитоавтотрофия | Цианобактерии, пурпурные, зелёные бактерии, из эукариот: растения |
| Органические соединения | Фотолитогетеротрофия | Некоторые цианобактерии, пурпурные, зелёные бактерии | ||
| Органические вещества | Углекислый газ | Фотоорганоавтотрофия | Некоторые пурпурные бактерии | |
| Органические вещества | Фотоорганогетеротрофия | Галобактерии, некоторые цианобактерии,пурпурные, зелёные бактерии | ||
Из таблицы видно, что разнообразие типов питания прокариот в разы больше чем у эукариот (последние способны лишь к хемоорганогетеротрофии и фотолитоавтотрофии).
6. Химическое строение и структурная организация вирусов, морфология, особенности взаимодействия с клеткой-хозяином.
Вирусы не имеют клеточного строения. Каждая вирусная частица состоит из расположенного в центре носителя генетической информации и оболочки. Генетический материал представляет собой короткую молекулу нуклеиновой кислоты, это образует сердцевину вируса. Нуклеиновая кислота у разных вирусов может быть представлена ДНК или РНК, причем эти молекулы могут иметь необычное строение: встречается однонитчатая ДНК и двух нитчатая РНК.
Оболочка называется капсид. Она образована субъединицами – капсомерами, каждый из которых состоит из одной или двух белковых молекул. Число капсомеров для каждого вируса постоянно (в капсиде вируса полиомиелита их 60, а у вируса табачной мозаики – 2130). Иногда нуклеиновая кислота вместе с капсидом называется нуклеокапсидом. Если вирусная частица кроме капсида, больше не имеет оболочки, её называют простым вирусом, если имеется ещё одна – наружная, вирус называется сложным. Наружную оболочку также называют суперкапсидом, генетически она не принадлежит вирусу, а происходит из плазматической мембраны клетки-хозяина и формируется при выходе собранной вирусной частицы из инфицированной клетки.
У каждого вируса капсомеры капсида располагаются в строго определённом порядке, благодаря чему возникает определённый тип симметрии. При спиральной симметрии капсид приобретает трубчатую (вирус табачной мозаики) или сферическую (РНК-содержащие вирусы животных) форму. При кубической симметрии капсид имеет форму икосаэдра (двадцатигранника), такой симметрией обладают изометрические вирусы. В случае комбинированной симметрии капсид обладает кубической формой, а расположенная внутри нуклеиновая кислота уложена спирально. Правильная геометрия капсида даже позволяет вирусным частицам совместно образовывать кристаллические структуры.
Непременным компонентом вирусной частицы является одна из двух нуклеиновых кислот, белок и зольные элементы. Эти три компонента являются общими для вирусов, тогда как остальные двалипоиды и углеводы - входят в состав далеко не всех вирусов.
Вирусы, состоящие только из белка нуклеиновой кислоты и зольных элементов, чаще всего принадлежат к группе простых вирусов, лишенных дифференциации, собственных ферментов или каких-либо специализированных структур - вирусы растений, некоторые вирусы животных и насекомых. В то же время практически все бактериофаги, которые по химическому составу, принадлежат к группе минимальных вирусов, на самом деле являются очень сложными и высокодифференцированными структурами.
Вирусы, в состав которых наряду с белком и нуклеиновой кислотой входят также липоиды и углеводы, как правило, принадлежат к группе сложно устроенных вирусов. Большая часть вирусов этой группы паразитирует на животных.
Белок всех исследованных до настоящего времени вирусов построен из обычных аминокислот, принадлежащих к естественному L-ряду. Соотношение аминокислот в вирусных белках достаточно близко к таковому в белках животных, бактерий и растений.
Вирусные белки не содержат обычно большого количества основных аминокислот (аргинина, муцина). Не учитывая нейтральных аминокислот, можно сказать, что в вирусном белке преобладают кислые дикарбоновые кислоты. Это справедливо для вирусов с низким и высоким содержанием нуклеиновых кислот.
Молекулы вирусных ДНК могут быть линейными или кольцевыми, двух цепочечными или одно цепочечными по всей своей длине или же одно цепочечными только на концах. Кроме того, выяснилось, что большинство нуклеотидных последовательностей в вирусном геноме встречается лишь по одному разу, однако на концах могут находиться повторяющиеся, или избыточные участки. Помимо различий в форме молекулы и в структуре концевых участков вирусных ДНК существуют также различия в величине генома.
Исследования вирусной РНК составили один из самых значительных вкладов вирусологии в молекулярную биологию. Тот факт, что у вирусов растений реплицируемая генетическая система состоит только из РНК, ясно показал, что и РНК способна сохранять генетическую информацию. Была установлена инфекционность РНК вируса табачной мозаики, и выяснилось, что для инфекции необходима вся ее молекула.
Размеры вирионов РНК - вирусов сильно варьируют - от 7.106 до 2.108 дальтон, однако размеры РНК и, следовательно, объем содержащейся в ней информации различаются в значительно меньшей степени.
Четверым компонентом, обнаруживаемым иногда в очищенных вирусных препаратах, являются углеводы (в количестве, превышающем содержание сахара в нуклеиновой кислоте). Глюкоза и гентибиоза обнаружена в составе некоторых фагов. Помимо этих углеводов, в составе бактериофагов могут быть и другие полисахариды. Единственная группа вирусов, в которой наличие углеводов точно доказано - вирусы животных. В составе элементарных телец вируса гриппа и классической чумы птиц находятся до 17 % углеводов.
Наиболее важный из таких компонентов двойной слой липидов, образующий основную массу наружной оболочки у тех вирусов, у которых она имеется. Полагают, что липиды оболочек просто заимствуются из плазматической мембраны клетки-хозяина и поэтому, строго говоря, не могут считаться вирус специфическими.
Высокоочищенные препараты вирионов содержат ряд низкомолекулярных компонентов. У бактериофагов и вирусов животных и растений обнаружены полиамины. Возможно, что их физиологическая функция состоит в нейтрализации отрицательного заряда нуклеиновой кислоты. Например, вирус герпеса содержит достаточно спермина, чтобы нейтрализовать половинку вирусной ДНК, а в вирусной оболочке присутствует спермидин.
В состав некоторых вирусов растений (морщинистости турнепса, крапчатости фасоли, табачной мозаики) входит бис амин.
Вирусная частица - это инертная статическая форма вируса. Когда вирионы находятся вне клетки, они не размножаются и в них не происходит никаких метаболических процессов. Все динамические события начинаются лишь тогда, когда вирус проникает в клетку. Даже у многоклеточного хозяина решающие события при вирусной инфекции происходят на клеточном уровне. Распространение вируса совершается в результате повторных циклов взаимодействия вируса с клетками и рассеяния вирионов во внеклеточной среде.
В зараженных вирусом клетках происходит глубокая перестройка вирусного материала, а часто также и компонентов клетки-хозяина. Возникает новая система - комплекс вирус-клетка. Репродукция вирусов – процесс многоэтапный, который можно разделить на семь стадий:
1.Адсорбция. Это процесс прикрепления вирусов к поверхности восприимчивой клетки. Вначале вирионы адсорбируются посредством электростатического взаимодействия или за счёт ван-дер-ваальсовых сил. Эта стадия обратима: вирус можно отделить обычным встряхиванием.
2.Инъекция. Связана с введением (инъекцией) в клетку инфекционной нуклеиновой кислоты вируса (как у фагов) или проникновением в клетку целой вирусной частицы с последующим «раздеванием» вируса от белковой оболочки и высвобождением инфекционной нуклеиновой кислоты.
3.Депротеинизация. В ходе её происходит освобождение носителя генетической информации вируса – его нуклеиновой кислоты. У бактериофагов этот процесс совпадает с предыдущей стадией.[1]
4.Репликация вирусных молекул нуклеиновой кислоты. Репликация идёт за счет нуклеотидов, накопленных в клетке хозяина.
5.Синтез вирус специфических структурных белков и ферментов. Процесс синтеза идёт в рибосомах клетки хозяина.
6.Сборка (самоорганизации) вирусных частиц. Для этого необходимо, чтобы концентрация компонентов вириона достигла высокого (критического) уровня. Компоненты вирусной частицы синтезируются раздельно и в разных частях клетки.[2] Сначала происходит комплексирование нуклеиновых кислот с частью белков и образование нуклеопротеидов. Последние покрываются оболочками. В состав этих оболочек входят часто некоторые компоненты клеточной мембраны.
Лизис. У бактерий распад клеток происходит под влиянием ферментов фага, а у клеток высших организмов – путём выпячивания оболочки клеток и «выталкивания» вирусных частиц в окружающую среду.
Бактериофаги вирусы бактерий. Впервые описаны Ф. Туортом (1915), а термин был введён Ф. Д’Эреллем (1917).
Рассмотрим типичный бактериофаг на примере вируса кишечной палочки. Тело фага состоит из головки, от которой отходит полый стержень, окружённый чехлом из сократительного белка. Стержень заканчивается базальной пластинкой, на которой закреплены шесть нитей. Внутри головки находится ДНК.
Бактериофаг при помощи отростков прикрепляется к поверхности кишечной палочки и в месте соприкосновения с ней растворяет с помощью фермента клеточную стенку. После этого за счёт сокращения головки молекула ДНК фага впрыскивается через канал стержня в клетку. Примерно через 10-15 мин под действием этой ДНК перестраивается весь метаболизм бактериальной клетки, и она начинает синтезировать ДНК бактериофага, а не собственную. При этом синтезируется и фаговый белок. Завершается процесс появлением 200-1000 новых фаговых частиц, в результате чего клетка бактерии погибает.
Бактериофаги, образующие в заражённых клетках новое поколение фаговых частиц, что приводит к лизису (распаду) бактериальной клетки, называются вирулентными фагами.
Некоторые бактериофаги внутри клетки хозяина не реплицируются. Вместо этого их нуклеиновая кислота включается в ДНК хозяина, образуя с ней единую молекулу, способную к репликации. Такие фаги получили название умеренных фагов или профагов.
Прокариоты не дифференцируются в стволовые или специализированные клетки, а являются популяцией более или менее сходных клеток, которые продолжают размножаться, пока имеется соответствующая питательная среда. Поэтому взаимодействие фагов с бактериями происходит в бактериальной культуре циклически, пока не наступит некое равновесное состояние, которое определяется числом клеток-хозяев и вирусных элементов и скоростью их воспроизведения.
7. Понятие биологической системы, биологического объекта, гомеостаз.
Понятие открытой системы ввел Л. фон Берталанфи. Основные отличительные черты открытых систем - способность обмениваться со средой массой, энергией и информацией. К ним безусловно относятся биологические системы.
Одна из наиболее полных и интересных классификаций по уровням сложности предложена К. Боулдингом. Выделенные в ней уровни приведены в табл. 1.
| Тип системы | Уровень сложности | Примеры |
| Живые системы |
Открытые системы с самосохраняемой структурой (первая ступень, на которой возможно разделение на живое и неживое) |
Клетки, гомеостат |
|
Живые организмы с низкой способностью воспринимать информацию |
Растения | |
|
Живые организмы с более развитой способностью воспринимать информацию, но не обладающие самосознанием |
Животные | |
|
Системы, характеризующиеся самосознанием, мышлением и нетривиальным поведением |
Люди | |
| Социальные системы | Социальные организации | |
|
Трансцендентные системы или системы, лежащие в настоящий момент вне нашего познания |
Мир живых существ, включая человека, представлен биологическими (живыми) системами различной структурной организации и разного уровня соподчинения, или согласованности. Остановимся на понятии «биологическая система», признаках биологических систем и их уровнях.
Биологические системы – это объекты различной сложности, имеющие несколько уровней структурно-функциональной организации и представляющие собой совокупность взаимосвязанных и взаимодействующих элементов.
Примерами биологических систем являются: клетка, ткани, органы, организмы, популяции, виды, биоценозы, экосистемы разных рангов и биосфера.
Элементарной биологической системой, т.е. системой самого низшего ранга, является клетка, т.к. нет систем еще более низкого ранга, которые бы обладали всей совокупностью признаков, присущих биологическим системам.
Человек занимает особое место среди систем, он не только живет в мире систем, но и сам является системой, персонифицированной составляющей природы.
Гомеостаз
Жизнедеятельность организма, как открытой биосистемы обеспечивается процессами, упорядоченными во времени и пространстве, приуроченными к определённой системе жизнеобеспечения. Эти процессы образуют три потока:
1.информационный 2.поток веществ 3.поток энергии
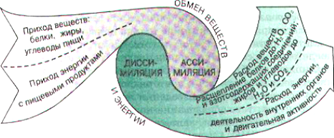
Вследствие целого ряда сложных химических превращений вещества из окружающей среды уподобляются веществам живого организма и из них строится тело. Эти процессы называют ассимиляцией или пластическим обменом.
С другой стороны сложные органические соединения распадаются на простые, при этом утрачивается их сходство с веществами организма и выделяется энергия, необходимая для реакций биосинтеза. Эти процессы называют диссимиляцией или энергетическим обменом.
Обмен веществ обеспечивает гомеостаз организма.
Эти потоки осуществляются непрерывно и составляют условия существования организма в постоянно меняющейся окружающей среде.
Под руководством нервной и эндокринной систем системы жизнеобеспечения поддерживают процессы внутри организма в оптимальном режиме.
"Гомеостаз – относительное динамическое постоянство состава и свойств внутренней среды, а также устойчивость физиологических функций организма".
К. Бернар Гомеостаз - это способность организма поддерживать основные параметры жизнедеятельности на оптимальном уровне. Важным аспектом гомеостаза организма является стабильность развития (морфогенетический гомеостаз) -способность организма к формированию генетически детерминированного фенотипа при минимальном уровне онтогенетических нарушений.
8. Отличия в строении рибосом прокариотов и эукариотов.
Процесс трансляции у про- и эукариот отличается незначительно. Идет он с помощью рибосом - самых мелких и самых многочисленных из клеточных органоидов.
Прокариотическая клетка содержит несколько тысяч рибосом, в эукариотической клетке их в десятки раз больше.
Рибосомы про- и эукариот отличаются по размерам (у прокариот они мельче, чем у эукариот), но принцип их строения одинаков. Состоят рибосомы из двух частей: большой и малой субъединиц. В их состав кроме белков входят РНК. Эти РНК получили название рибосомных, рРНК.
Величину рибосом и составляющих их частей принято указывать в специальных единицах - S (Сведберг). S - это коэффициент седиментации, который характеризует скорость перемещения молекул или частиц в центробежном поле при центрифугировании. Скорость перемещения зависит от массы частиц, их размеров и формы. Величина рибосом прокариот и эукариот - 70S и 80S соответственно.
В рибосомы прокариот входит три разных вида молекул рРНК (16S рРНК - в малую; 23S рРНК и 5S рРНК - в большую субъединицы) и 55 различных белков (21 - в малую и 34 - в большую субъединицы). В состав эукариотических рибосом входят четыре вида молекул рРНК (18S рРНК - в малую; 28S рРНК, 5.8S рРНК и 5S рРНК - в большую субъединицы) и около 80 белков.
В митохондриях и хлоропластах также обнаружены рибосомы. Они характеризуются теми же свойствами и параметрами, что и рибосомы прокариот.
Молекулы рРНК взаимодействуют друг с другом и с белками, образуя компактные структуры - субъединицы рибосом.
У эукариот соединение рРНК с рибосомными белками происходит в ядрышке. В центре ядрышка расположен участок хромосомы, в котором находятся гены рибосомных РНК. Синтезированные рРНК соединяются с рибосомными белками, которые поступили через ядерные поры из цитоплазмы, где они были синтезированы на уже существовавших рибосомах. Они соединяются с молекулами рРНК, образуя субъединицы рибосом. Готовые субъединицы через поры выходят в цитоплазму, где будут участвовать в синтезе белка.
Таким образом, ядрышко - это не только место синтеза рибосомных РНК, но и место сборки субъединиц рибосом. Рибосомы нужны в огромных количествах, поскольку в клетке постоянно идут процессы синтеза белка. Поэтому на хромосомах в тех местах, где расположены гены рРНК, находится громадное скопление молекул: синтезируемые рРНК, пришедшие из цитоплазмы рибосомные белки, собираемые и готовые суъединицы рибосом. Понятно, почему ядрышко является самой плотной частью ядра и клетки.
Размеры ядрышка зависят от функционального состояния клеток. Если в клетке активно идут процессы биосинтеза белков, ядрышко может занимать до 25% от объема ядра.
Ядрышко образуется на тех хромосомах, где есть гены рРНК. Эти участки хромосом называются ядрышковыми организаторами. Например, у человека десять хромосом способны образовывать ядрышки. Каждый ядрышковый организатор представляет собой огромную хроматиновую петлю, так как содержит несколько десятков и даже сотен одинаковых последовательностей - генов рРНК. Эти последовательности расположены друг за другом и синтез рРНК идет одновременно со всех копий. Таким образом увеличивается интенсивность синтеза рРНК, на долю которой приходится более 90 % всей РНК клетки. Ядрышки, образованные разными хромосомами, очень часто сливаются друг с другом. В ядрах клеток человека обычно наблюдают одно, два или три ядрышка.
При начале трансляции малая субъединица рибосомы связывается с определенным участком иРНК, к ним присоединяется тРНК с аминокислотой, а затем с этим комплексом связывается большая субъединица. После этого рибосома готова к выполнению своей функции - синтезу белка. Белки рибосом способны выполнять свои функции только в составе рибосомы -только в комплексе с рРНК и другими рибосомными белками они приобретают небходимую конформацию.
Транспортная РНК, напоминает в развернутой форме клеверный лист. Аминокислота прикреплена к “черешку клеверного листа”, а на вершине листа находится триплет, взаимодействующий с кодоном в иРНК - антикодон.
Роль "заглавной буквы" при трансляции аминокислотной последовательности у прокариот выполняет измененная форма аминокислоты метионина - формилметионин. Ей соответствует кодон АУГ. После завершения синтеза полипептидной цепи формилметионин отщепляется и в готовом белке отсутствует. В том случае, когда триплет АУГ стоит внутри гена, он кодирует неизмененную аминокислоту метионин.
Если кодон и антикодон комплементарны друг другу, то рибосома передвигается относительно иРНК, и следующий кодон становится доступным для взаимодействия со следующей тРНК. Происходит отсоединение первой аминокислоты от первой тРНК и присоединение ее к аминокислоте, которую принесла вторая тРНК. Во время передвижения рибосомы относительно иРНК первая тРНК, свободная от аминокислоты, покидает рибосому. Вторая тРНК остается, соединенная с пептидом из двух аминокислотных остатков, и в рибосому входит третий кодон иРНК для взаимодействия с очередной тРНК и т.д.
Когда в рибосоме оказывается один из трех триплетов (УАА, УАГ, УГА), ни одна тРНК не может занять место напротив него, так как не существует тРНК с антикодонами, комплементарными этим последовательностям. Полипептидной цепи не к чему присоединиться и она покидает рибосому. Синтез белка завершен.
Таким образом, рибосома соединяет в одном месте участников трансляции: иРНК и аминокислоты в комплексе с тРНК, при этом молекулы РНК так ориентированы относительно друг друга, что становится возможным кодон-антикодоновое взаимодействие. Образование пептидной связи контролируется правильностью кодон-антикодонового взаимодействия. Рибосома осуществляет образование пептидной связи и перемещение относительно иРНК.
Молекула информационной РНК взаимодействует не с одной рибосомой, а с несколькими. Каждая рибосома проходит весь путь от "заглавного" кодона до терминирующего, синтезируя одну молекулу белка. Чем больше рибосом пройдет по иРНК, тем больше молекул белка будет синтезировано. Молекула информационной РНК с несколькими рибосомами похожа на нитку бус и называется полирибосомой, или полисомой.
9. Основные фазы роста микроорганизмов.
При выращивании бактерий в жидкой питательной среде наблюдается несколько фаз роста культур:
1. Фаза исходная (латентная) — микробы адаптируются к питательной среде, увеличивается размер клеток. К концу этой фазы начинается размножение бактерий.
2. Фаза логарифмического инкубационного роста — идет интенсивное деление клеток. Длится эта фаза около 5 часов. При оптимальных условиях бактериальная клетка может делиться каждые 15—30 мин.
3. Стационарная фаза — число вновь появившихся бактерий равно числу отмерших. Продолжительность этой фазы выражается в часах и колеблется в зависимости от вида микроорганизмов.
4. Фаза отмирания — характеризуется гибелью клеток в условиях истощения питательной среды и накопления в ней продуктов метаболизма микроорганизмов.
Посевной материал, попав в свежую полноценную среду, сразу не начинает размножения. Этот период называют лаг-фазой I. Только после определенного времени, иногда через несколько часов, клетки приспосабливаются к среде и окружающим условиям. В этот период активируются ферменты, а также, если это необходимо, синтезируются новые ферментные системы. В период лаг-фазы стремительно возрастает количество нуклеиновых кислот, особенно РНК, что необходимо для биосинтеза белков.
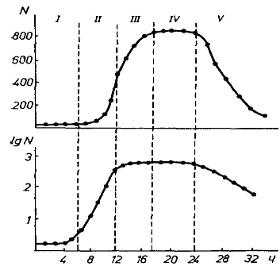
Рис. 1. Фазы роста культуры микроорганизмов: I — лаг-фаза, II — логарифмическая фаза, III — фаза замедленного роста, IV — стационарная фаза, V —фаза отмирания, N — число клеток (млн/мл)
После лаг-фазы следует логарифмическая, или экспоненциальная, фаза II, в которой клетки размножаются с максимальной для данной культуры скоростью. Вследствие этого запас необходимых питательных веществ в среде уменьшается, кроме того, происходит накопление различных продуктов обмена веществ, которые в определенной концентрации могут мешать нормальному протеканию биохимических процессов обмена веществ. Иногда в питательной среде накапливается так много клеток, что не хватает пространства, а конкретнее, поверхности для новых поколений клеток. Именно через поверхность происходят процессы обмена — попадание питательных веществ в клетку и выведение метаболитов. Если клетка находится в тесном окружении других клеток, то площадь поверхности уменьшается и вместе с тем снижается интенсивность процессов обмена. Скорость роста культуры также уменьшается, если сокращается поверхность клеток на единицу объема. Это происходит при увеличении размеров клеток и, таким образом, особенно для клеток сферической формы, значительно ухудшаются условия питания.
Как известно, поверхность сферических тел изменяется пропорционально квадрату их радиуса, а объем — пропорционально кубу радиуса. Лимитирующие поверхности находятся, очевидно, и внутри клеток. В молекулярной биологии накапливается все больше фактов, которые указывают на то, что функционирование жизненных процессов необходимо связывать с биополимерами, мембранными структурами и их поверхностью.
В ходе интенсивного роста и размножения внутри закрытой системы негативное влияние лимитирующих факторов увеличивается и в результате скорость роста уменьшается, наступает фаза замедленного роста III. Через определенное время в стационарной фазе IV масса клеток в питательной среде достигает максимального уровня. Затем наступает период, когда число отмерших и автолизированных клеток превышает прирост. В результате количество биомассы уменьшается — наступает фаза отмирания V.
10. Характеристика молочнокислого и спиртового брожения
Молочнокислое брожение — как обыкновенно принимают, идет согласно следующему уравнению С12H22О 11 (молочный сахар) + H2O = 4С3Н6О3 (молочная кислота), если же сбраживается декстроза или вещества, способные переходить в декстрозу, то гидратации не происходит (Bourquelot): С6Н12О6 = 2С3Н6О3. Возбудителями Молочнокислого брожения являются многие виды бактерий, среди которых можно указать кишечную палочку (Bacterium coli commune), Micrococcus prodigiosus и др., но чаще всего встречается в скисшем молоке Bacterium acidi lactici. Этот аэробный микроорганизм имеет вид коротенькой палочки, иногда перетянутой посередине, иногда состоящей из двух, трех члеников. Споры у него эндогенные, желатину не разжижает и дает на ней белую колонию. Впервые возбудитель М. брожения был описан Пастером (1857) под назв. «фермент или дрожжи М. брожения», чистых культур его Пастер не получил. Первую чистую культуру получил Листер (1877) и назвал выделенный им организм Bacterium lactis. Выделенный Гюппе (1884) из кислого молока микроорганизм, названный им Bacillus acidi lactici, по-видимому, тождествен с описанным Листером. В настоящее время описано много М. бактерий, отличающихся между собой иногда не только морфологически, но и в различной степени выраженной сбраживающей способностью. Продуктом брожения чаще всего является недеятельная молочная кислота (этиледенмолочная кислота, СН 3 — СНОН — СООН или так назыв. молочная кислота брожения), но одновременно с ней могут образоваться одна или обе оптически деятельные кислоты (правая или парамолочная кислота или мясомолочная кислота и левая молочная кислота). Определенные бактерии при определенных условиях образуют одинаковые кислоты; формы, образующие, наприм., правовращающую кислоту при обыкновенных условиях, дают левовращающую кислоту, если температура достигнет 50° Ц. (Лейхманн). В последнее время не осталось никаких сомнений в том, что деятельность этих микроорганизмов обусловливается специфическим энзимом. Ср. Lafar, «Handbuch d. Technischen Mykologie» (Иена) и Lafar, «Бактерии и грибки» (СПб., 1903, где можно найти относящуюся сюда литературу).
Спиртовое брожение осуществляется так называемыми дрожжеподобными организмами, а также некоторыми плесневыми грибками. Суммарную реакцию спиртового брожения можно изобразить следующим образом:
![]()
Механизм реакции спиртового брожения чрезвычайно близок к гликолизу. Расхождение начинается лишь после этапа образования пирувата. При гликолизе пируват при участии фермента ЛДГ и кофермента НАДН восстанавливается в лактат. При спиртовом брожении этот конечный этап заменен двумя другими ферментативными реакциями – пируватдекарбо-ксилазной и алкогольдегидрогеназной.
В дрожжевых клетках (спиртовое брожение) пируват вначале подвергается декарбоксилированию, в результате чего образуется ацетальдегид. Данная реакция катализируется ферментом пируватдекарбоксилазой, который требует наличия ионов Mg и кофермента (ТПФ):

Образовавшийся ацетальдегид присоединяет к себе водород, отщепляемый от НАДН, восстанавливаясь при этом в этанол. Реакция катализируется ферментом алкогольдегидрогеназой:

Таким образом, конечными продуктами спиртового брожения являются этанол и СО2, а не молочная кислота, как при гликолизе.
Процесс молочнокислого брожения имеет большое сходство со спиртовым брожением. Отличие заключается лишь в том, что при молочнокислом брожении пировиноградная кислота не декарбоксилируется, а, как и при гликолизе в животных тканях, восстанавливается при участии ЛДГ за счет водорода НАДН.
Известны 2 группы молочно-кислых бактерий. Бактерии одной группы в процессе брожения углеводов образуют только молочную кислоту, а бактерии другой из каждой молекулы глюкозы «производят» по одной молекуле молочной кислоты, этанола и СО2.
Существуют и другие виды брожения, конечными продуктами которых могут являться пропионовая, масляная и янтарная кислоты, а также другие соединения.
11. Характеристика основных потребностей микроорганизмов в макро- и микроэлементах. Ауксотрофы и прототрофы.
Для роста и размножения бактерий, а, следовательно, и для их питания, необходимы различные химические соединения, растворенные в воде. По количественному вкладу в построение клетки различают макро- и микроэлементы. К макроэлементам относят 10 элементов таблицы Менделеева: углерод, водород, кислород, азот, серу, калий, кальций, фосфор, магний, железо. Микроэлементы нужны бактериям в очень малых, следовых, количествах, они представлены марганцем, молибденом, цинком, медью, кобальтом, никелем, хлором, бромом и некоторыми другими металлами и неметаллами. Большинство из них содержится в виде примесей в макроэлементах или может попадать в питательные среды из стеклянной посуды, воды или воздуха. Некоторые бактерии могут обходится и без микроэлементов.
Для роста микроорганизмов так же необходим азот, который входит в состав органических соединений или солей в разной степени восстановления. Это могут быть соли аммония, нитраты или отдельные аминокислоты. Для удовлетворения потребности бактерий в азоте используют также продукты неполного расщепления белков животного происхождения - гидролизаты , пептоны и сложные белковые смеси - нативную сыворотку животных, асцитическую жидкость и др.
Кроме углерода, азота и других химических элементов, многие бактерии нуждаются в факторах роста, к которым относятся витамины, основания нуклеиновых кислот и другие биологически активные вещества. По этому признаку микроорганизмы можно разделить на две группы: ауксотрофы , для которых в среде необходимо наличие одного или нескольких факторов роста и прототрофы , они в факторах роста не нуждаются.
12. Механизм регуляции активности ферментов в микроорганизмах.
Поскольку практически все реакции в клетке катализируются ферментами, регуляция метаболизма сводится к регуляции интенсивности ферментативных реакций. Скорость последних может регулироваться двумя основными способами: путем изменения количества ферментов и/или изменения их активности, т. с. степени испольвания их каталитического потенциала.
Регуляция активности ферментов
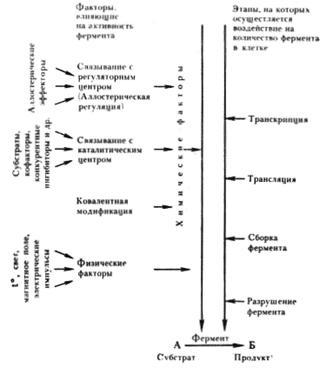
Рис. 28. Регуляторные воздействия на уровень клеточных метаболитов (продуктов)
Факторы, регулирующие активность ферментов, разнообразны по своей природе (рис. 28). Физические факторы (температура, давление, свет, магнитное поле, электрические импульсы оказывают менее специфическое действие, чем химические. В свою очередь действие последних также может быть разделено на несколько типов. Одни химические вещества связываются с активным центром фермента, например субстраты, кофакторы, конкурентные ингибиторы, что приводит к изменению ферментативной активности. Другие вещества взаимодействуют со специальными участками на поверхности молекулы определенного типа фермента, не имеющими непосредственного отношения к центрам каталитической активности, но тем не менее приводящими к ее изменению.
Наконец, активность некоторых ферментов регулируется путем химической модификации их молекулы, в основе которой лежит ковалентное обратимое связывание с ферментом определенной группировки, что приводит к изменению его активности. У прокариот известны две ферментные системы, активность которых регулируется таким путем. Глутаминсинтетаза E. coli, катализирующая синтез глутамина, существует в двух формах, различающихся присутствием в одной из них остатка адениловой кислоты. Присоединение его с помощью ковалентной связи, катализируемое соответствующим модифицирующим ферментом, приводит к образованию менее активной аденилированной глутаминсинтетазы:
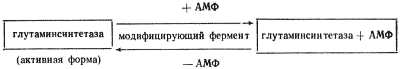
Удаление адениловой группы, ведущее к возникновению деаденилированной формы фермента, резко повышает его каталитическую активность. Аналогичный механизм регулирования активности фермента путем присоединения и удаления остатка уксусной кислоты (ацетилирование — деацетилирование) обнаружен для цитратлиазы у фотосинтезирующей бактерии Rhodopseudomonas gelatinosa. В этом случае активна ацетилированная форма фермента.
Наиболее быстрым, точным и тонким механизмом регуляции активности ферментов является регуляция, которой подвергается определенный тип ферментов, получивших название аллостерических21. Эти ферменты, как правило, занимают ключевые позиции в обмене веществ, располагаясь в "стратегических" пунктах клеточного метаболизма — начале метаболических путей или местах разветвлений, где расходятся или сходятся несколько путей.
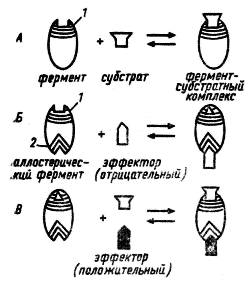
Рис. 29. Связывание субстрата с ферментом (А) и действие отрицательного (Б) и положительного (И) эффектора на каталитическую активность аллостерического фермента: 1 — каталитический центр; 2 регуляторный центр (no Schlegel, 1972)
Аллостерические ферменты имеют каталитический и регуляторный (аллостерический) центры, пространственно разобщенные, но функционально тесно взаимосвязанные. Каталитическая активность фермента меняется в результате связывания с его регуляторным центром определенных метаболитов, называемых эффекторами. Кроме конечных продуктов данного пути, эффекторами могут быть субстраты ферментов, а также некоторые конечные продукты родственных метаболических путей. Если действие эффектора приводит к понижению каталитической активности фермента, такой эффектор называется отрицательным, или ингибитором. Положительным называют эффектор, действие которого повышает каталитическую активность фермента. Положительным эффектором, или активатором, чаще всего бывает субстрат данного фермента.
Связывание эффектора с регуляторным центром приводит к изменению сродства фермента к субстрату в результате какого-то конформационного изменения фермента (рис. 29).
Наиболее простой случай аллостерической регуляции регуляция первого фермента неразветвленного биосинтетического пути его конечным продуктом. Если конечный продукт накапливается в избытке, он подавляет активность первого фермента в процессе, называемом ингибированием по принципу обратной связи Примером такого типа регулирования является ингибирование биосинтеза L-изолейцина (рис. 30) Первый фермент на пути синтеза L-изолейцина L-треониндезаминаза является аллостерическим и ингибируется только L-изолейцином.

Рис. 30. Регуляция биосинтеза L-изолейцина по механизму отрицательной обратной связи; ф, — треониндезаминаза; ф — фз ферменты, катализирующие промежуточные стадии биосинтеза L-изолейцина. Стрелкой показано ингибирование треониндезамнназы L-изолейцином
13. Механизм поглощения субстратов у микроорганизмов.
Основной источник энергии в клетке - окисление субстратов кислородом воздуха. Этот процесс осуществляется тремя путями: присоединением кислорода к атому углерода, отщеплением водорода или потерей электрона. В клетках окисление протекает в форме последовательного переноса водорода и электронов от субстрата к кислороду. Кислород играет в этом случае роль восстанавливающегося соединения (окислителя). Окислительные реакции протекают с высвобождением энергии. Для биологических реакций характерны сравнительно небольшие изменения энергии. Это достигается за счет дробления процесса окисления на ряд промежуточных стадий, что позволяет запасать ее небольшими порциями в виде макроэргических соединений (АТФ). Восстановление атома кислорода при взаимодействии с парой протонов и электронов приводит к образованию молекулы воды.
Тканевое дыхание
Это процесс потребление клетками тканей организма кислорода, который участвует в биологическом окислении. Такой вид окисления называют аэробным окислением. Если конечным акцептором в цепи переноса водорода выступает не кислород, а другие вещества (например пировиноградная кислота), то такой тип окисления называют анаэробным.
Т.о. биологическое окисление - это дегидрирование субстрата с помощью промежуточных переносчиков водорода и его конечного акцептора.
Дыхательная цепь (ферменты тканевого дыхания) - это переносчики протонов и электронов от окисляемого субстрата на кислород. Окислитель - это соединение, способное принимать электроны. Такая способность количественно характеризуется окислительно-восстановительным потенциалом по отношению к стандартному водородному электроду, рН которого равен 7,0. Чем меньше потенциал соединения, тем сильнее его восстанавливающие свойства и наоборот.
Т. о. любое соединение может отдавать электроны только соединению с более высоким окислительно-восстановительным потенциалом. В дыхательной цепи каждое последующее звено имеет более высокий потенциал, чем предыдущее.
Дыхательная цепь состоит из:
1.НАД - зависимой дегидрогеназы;
2.ФАД- зависимой дегидрогеназы;
3.Убихинона (КоQ);
4.Цитохрмов b, c, a+a3 .
НАД-зависимые дегидрогеназы. В качестве кофермента содержат НАД и НАДФ. Пиридиновое кольцо никотинамида способно присоединять электроны и протоны водорода.
ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 (ФАД).
Убихинон (КоQ) отнимает водород у флавопротеидов и превращается при этом в гидрохинон.
Цитохромы - белки хромопротеиды, способные присоединять электроны, благодаря наличию в своем составе в качестве простетических групп железопорфиринов. Они принимают электрон от вещества, являющегося немного боле сильным восстановителем, и передают его более сильному окислителю. Атом железа связан с атомом азота имидазольного кольца аминоксилоты гистидина с одной стороны от плоскости порфиринового цикла, а с другой стороны с атомом серы метионина. Поэтому потенциальная способность атома железа в цитохромах к связыванию кислорода подавлена.
В цитохроме с порфириновая плоскость ковалентно связана с белком через два остатка цистеина, а в цитохромах b и а, она ковалентно не связано с белком.
В цитохроме а+а3 (цитохромоксидазе) вместо протопорфирина содержатся порфирин А, который отличатся рядом структурных особенностей. Пятое координационное положение железа занято аминогруппой, принадлежащей остатку аминосахара, входящего в состав самого белка.
В отличии от гема гемолгобина атом железа в цитохромах может обратимо переходить из двух в трехвалентное состояние это обеспечивает транспорт электронов (См. подробнее приложение 1 "Атомная и электронная структура гемопротеинов ").
Механизм работы электронтранспортной цепи
Наружная мембрана митохондрии (рис. 4.8.1) проницаема для большинства мелких молекул и ионов, внутренняя почти для всех ионов (кроме протонов Н) и для большинства незаряженных молекул.
Все вышеперечисленные компоненты дыхательной цепи встроены во внутреннюю мембрану. Транспорт протонов и электронов по дыхательной цепи обеспечивается разностью потенциалов между ее компонентами. При этом каждое увеличение потенциала на 0,16 В освобождает энергию, достаточную для синтеза одной молекулы АТФ из АДФ и Н3РО4. При потреблении одной молекулы О2 образуется 3 АТФ.
Процессы окисления и образования АТФ из АДФ и фосфорной кислоты т.е. фосфорилирования протекают в митохондриях. Внутренняя мембрана образует множество складок - крист. Пространство органиченное внутренней мембраной - матриксом. Пространство между внутренней и наружной мембранами называется межмембранным.
14. Характеристика пентозофосфатного пути расщепления глюкозы
Открытие пути прямого окисления углеводов, или, как его называют, пентозофосфатного цикла, принадлежит О. Варбургу, Ф. Липману, Ф. Дикенсу и В.А. Энгельгарду. Расхождение путей окисления углеводов – классического (цикл трикарбоновых кислот, или цикл Кребса) и пентозофос-фатного – начинается со стадии образования гексозомонофосфата. Если глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат, который фосфо-рилируется второй раз и превращается во фруктозо-1,6-бисфосфат, то в этом случае дальнейший распад углеводов происходит по обычному гликолитическому пути с образованием пировиноградной кислоты, которая, окисляясь до ацетил-КоА, затем «сгорает» в цикле Кребса.
Если второго фосфорилирования гексозо-6-монофосфата не происходит, то фосфорилированная глюкоза может подвергаться прямому окислению до фосфопентоз. В норме доля пентозофосфатного пути в количественном превращении глюкозы обычно невелика, варьирует у разных организмов и зависит от типа ткани и ее функционального состояния.
У млекопитающих активность пентозофосфатного цикла относительно высока в печени, надпочечниках, эмбриональной ткани и молочной железе в период лактации. Значение этого пути в обмене веществ велико. Он поставляет восстановленный НАДФН, необходимый для биосинтеза жирных кислот, холестерина и т.д. За счет пентозофосфатного цикла примерно на 50% покрывается потребность организма в НАДФН.
Другая функция пентозофосфатного цикла заключается в том, что он поставляет пентозофосфаты для синтеза нуклеиновых кислот и многих коферментов. При ряде патологических состояний удельный вес пентозофосфатного пути окисления глюкозы возрастает. Механизм реакций пентозофосфатного цикла достаточно расшифрован.
Пентозофосфатный цикл начинается с окисления глюкозо-6-фосфата и последующего окислительного декарбоксилирования продукта (в результате от гексозофосфата отщепляется первый атом углерода). Это первая, так называемая окислительная, стадия пентозофосфатного цикла. Вторая стадия включает неокислительные превращения пентозофосфатов с образованием исходного глюкозо-6-фосфата (рис. 3). Реакции пен-тозофосфатного цикла протекают в цитозоле клетки.
Первая реакция – дегидрирование глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатдегидрогеназы и кофермента НАДФ+. Образовавшийся в ходе реакции 6-фосфоглюконо-δ-лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью фермента 6-фосфоглюконолактоназы с образованием 6-фос-фоглюконовой кислоты (6-фосфоглюконат):
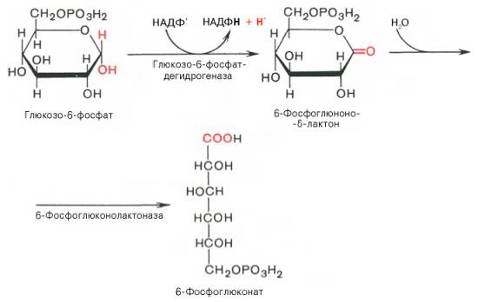
Во второй окислительной – реакции, катализируемой 6-фосфоглюко-натдегидрогеназой (декарбоксилирующей), 6-фосфоглюконат дегидрируется и декарбоксилируется. В результате образуется фосфорилированная кетопентоза – D-рибулозо-5-фосфат и еще 1 молекула НАДФН:
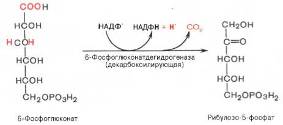
Под действием соответствующей эпимеразы из рибулозо-5-фосфата может образоваться другая фосфопентоза – ксилулозо-5-фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. Между этими формами пентозофосфатов устанавливается состояние подвижного равновесия:
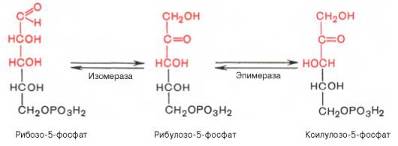
При определенных условиях пентозофосфатный путь на этом этапе может быть завершен. Однако при других условиях наступает так называемый неокислительный этап (стадия) пентозофосфатного цикла. Реакции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях. При этом образуются вещества, характерные для первой стадии гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотрио-зы), а другие – специфические для пентозофосфатного пути (седогептуло-зо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат).
Основными реакциями неокислительной стадии пентозофосфатного цикла являются транскетолазная и трансальдолазная. Эти реакции катализируют превращение изомерных пентозо-5-фосфатов:
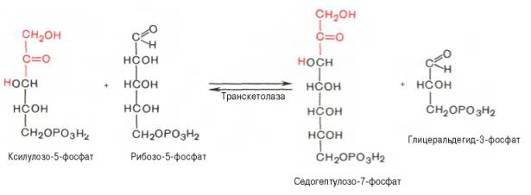
Коферментом в транскетолазной реакции служит ТПФ, играющий роль промежуточного переносчика гликольальдегидной группы от ксилулозо-5-фосфата к рибозо-5-фосфату. В результате образуется семиуглеродный моносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат.
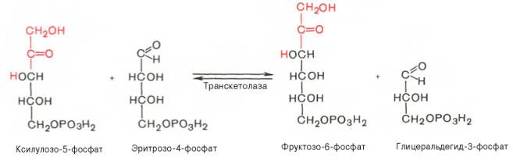
Транскетолазная реакция в пентозном цикле встречается дважды, второй раз – при образовании фруктозо-6-фосфата и триозофосфата в результате взаимодействия второй молекулы ксилулозо-5-фосфата с эритро-зо-4-фосфатом:
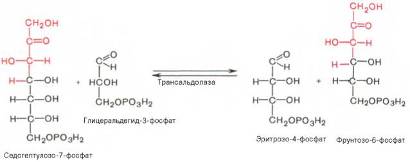
Фермент трансальдолаза катализирует перенос остатка диоксиацетона (но не свободного диоксиацетона) от седогептулозо-7-фосфата на гли-церальдегид-3-фосфат:
Шесть молекул глюкозо-6-фосфата, вступая в пентозофосфатный цикл, образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2, после чего из 6 молекул рибулозо-5-фосфата снова регенерируется 5 молекул глюко-зо-6-фосфата. Однако это не означает, что молекула глюкозо-6-фосфата, вступающая в цикл, полностью окисляется. Все 6 молекул СО2 образуются из С-1-атомов 6 молекул глюкозо-6-фосфата.
Валовое уравнение окислительной и неокислительной стадий пентозофосфатного цикла можно представить в следующем виде:
![]()
или
![]()
Образовавшийся НАДФН используется в цитозоле на восстановительные синтезы и, как правило, не участвует в окислительном фосфорилировании, протекающем в митохондриях.
15. Особенности пути Ембдена-Мейергофа-Парнаса (гликолиз)
Гексозодифосфатний шлях (гліколіз), або схема Ембдена – Мейєргофа-Парнаса, починається із глюкози і через ряд послідовних реакцій деградації призводить до утворення пірувату . Перша реакція відбувається з витратою енергії у вигляді макроергічного зв'язку АТФ і пов'язана з утворенням фосфорильованого похідного глюкози - глюкозо-6-фосфату. У наступній реакції відбувається ізомеризація глюкозо-6-фосфату у фруктозо-6-фосфат. При дії фосфофруктокінази відбувається утворення фруктозо-1,6-дифосфату. У наступній реакції під впливом альдолази утворюється дві триози: 3-фосфогліцериновий альдегід і фосфодиоксиацетон, які є ізомерами і тому можуть переходити один в одного. Альдолаза фруктозо-1,6-дифосфату є ключовим ферментом для цього шляху, виявлення активності якого чітко вказує на наявність гексозодифосфатного шляху. Наступні реакції пов'язані з окисненням 3-фосфогліцеринового альдегіду під впливом гліцераль-дегід-3-фосфатдегідрогенази з утворенням макроергічного зв'язку 1,3-дифосфо-гліцеринової кислоти. Наявний в цій речовині макроергічний зв'язок перетворюється в макроергічний зв'язок АТФ під час першого субстратного фосфо-рилювання. Друге фосфорилювання пов'язане з перетворенням макроергіч-но сполуки - фосфоенолпіровиноградної кислоти в піруват. Більш докладно механізми утворення АТФ під час двох субстратних фосфорилювань будуть описані в наступних розділах. Подальша доля пірувату у випадку аеробних процесів пов'язана з перетворенням в ацетил-КоА; в анаеробних умовах від пірувату можуть починатись перетворення за різними схемами процесів бродіння.
Як найбільш показовий приклад можна навести гомоферментативне молочнокисле бродіння, за якого з пірувату утворюється молочна кислота.
Процес спиртового бродіння відбувається за цією ж схемою, але піруват піддається декарбоксилюванню з утворенням ацетоальдегіду, який потім 'Дновлюється НАД+-залежною алкогольдегідрогеназою до етанолу.
Деякі види ентеробактерій здійснюють бродіння з утворенням цілої серії кислот, серед яких домінує мурашина, яка потім може піддаватись утилізації під дією ферменту форміатгідрогенази до С02 і Н2. Так реакції називають mурашинокислим бродінням. Для ентеробактерій також характерний особли-ним Шлях синтезу етанолу з пірувату через утворення ацетил-КоА з наступним відновленням його до етанолу.
Бродіння з утворенням ацетату може відбуватись декількома шляхам Один з них пов'язаний з відновленням СОг до оцтової кислоти; під час інш го відбувається утворення ацетату з ацетил-КоА.
Більш складним процесом є пропіоновокисле бродіння, яке складається фрагменту циклу Кребса на ділянці від щавлевооцтово до янтарної кислоти Кінцевий продукт бродіння - пропіонова кислота.
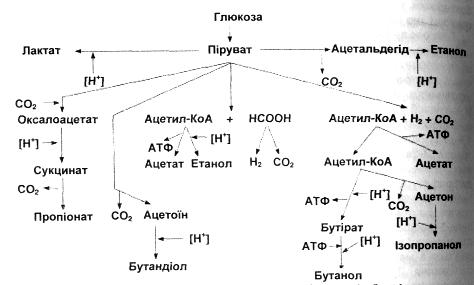
Найбільший спектр кінцевих продуктів утворюється в результаті маслянокислого бродіння: ізопропанол, масляна кислота, бутанол, ацетон, етанол, оцтова кислота.
16. ПУТЬ ЭНТНЕРА — ДУДОРОВА
Общая схема третьего пути расщепления углеводов эубактериями представлена на рис. 67.
Первые два его этапа — фосфорилирование молекулы глюкозы и ее дегидрирование до 6-фосфоглюконовой кислоты — идентичны первым двум этапам окислительного пентозофосфатного пути. Специфичны для пути Энтнера Дудорова две следующие реакции: 1) дегидратирование 6-фосфоглюконовой кислоты, приводящее к образованию КДФГ-кислоты; 2) расщепление продукта первой реакции на два C3-фрагмента. Конечными продуктами второй реакции являются пировиноградная кислота и 3-ФГА. Последний окисляется в пировиноградную кислоту так же, как в гликолитическом пути. Следовательно, при разложении молекулы глюкозы до пирувата по пути Энтнера — Дудорова образуется 1 молекула АТФ (2 молекулы АТФ синтезируются на отрезке пути 3-ФГА ® пировиноградная кислота минус 1 молекула АТФ, затраченная на фосфорилирование глюкозы), 1 молекула НАД-H2 и 1 молекула НАДФ-H2.
Путь Энтнера — Дудорова имеет важное значение, когда сбраживаемыми субстратами служат глюконовая, маннановая, гексуроновые кислоты или их производные. Он функционирует у довольно широкого круга эубактерии, главным образом, грамотрицательных, получающих энергию в процессе дыхания (энтеробактерии50, виды Azotobacter, Pseudomonas, Alcaligenes, Rhizobium, Spirillum, Xanthomonas, Thiobacillus и др.). У анаэробов он встречается довольно редко. В качестве примера организма, сбраживающего сахара по пути Энтнера — Дудорова, можно привести облигатно анаэробную бактерию Zymomonas mobilis. Однако ее изучение позволяет предполагать, что Z. mobilis вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера Дудорова обнаружен у некоторых клостридиев, что еще раз подчеркивает неоднородность эубактерий, объединенных в эту таксономическую группу.
У энтеробактерий гликолитический и окислительный пентозофосфатный пути функционируют как центральные конститутивные пути метаболизирования углеводов, путь Энтнера — Дудорова — как индуцибельный.
Согласно существующим представлениям путь Энтнера Дудорова сформировался позднее гликолитического и окислительного пентозофосфатного путей и возник как ответвление последнего, поскольку начала окислительного пентозофосфатного пути и пути Энтнера — Дудорова идентичны и для последнего необходимо было сформировать только два новых фермента (6-фосфоглюконатдегидратазу и КДФГ-альдолазу). Появление пути Энтнера Дудорова, вероятно, было вызвано высокой потребностью клеток в пирувате, поэтому возникла необходимость сформировать механизм, при помощи которого пируват образовывался бы из исходного субстрата как можно более коротким и прямым путем. Действительно, к получению пирувата по пути Энтнера — Дудорова ведут всего 4 реакции, в то время как в гликолитическом пути для этого требуется 9 ферментативных преобразований.
Как можно видеть из схемы процесса (рис. 67), путь Энтнера — Дудорова имеет несколько точек пересечения с гликолитическим и окислительным пентозофосфатным путями: 6-фосфоглюконовая кислота представляет собой промежуточное соединение пути Энтнера — Дудорова и окислительного пентозофосфатного; пируват и 3-ФГА — промежуточные соединения пути Энтнера Дудорова и гликолиза.
В природе есть много мест с полным или почти полным отсутствием молекулярного кислорода. Это глубокие слои воды, почвы, илы морей и континентальных водоемов. Особую экологическую нишу для развития анаэробов представляют рубец и кишечник животных и человека. Облигатно анаэробный способ существования широко распространен среди эубактерий. Систематическое изучение анаэробных эубактерий, предпринятое в последние десятилетия, обнаружило неоднородность входящих в эту группу организмов, способных получать энергию в процессах брожения, фотосинтеза и анаэробного дыхания.
Только небольшая часть облигатно анаэробных эубактерий может быть отнесена к первичным анаэробам, т. е. возникшим в докислородную эпоху и сохранившим до настоящего времени основные черты метаболизма того периода в результате обитания в анаэробных экологических нишах: получение энергии в процессе брожения, отсутствие электронтранспортных цепей, слабо развитые биосинтетические способности.
Большинство существующих облигатных анаэробов среди эубактерий имеют вторичное происхождение как следствие повторной адаптации к анаэробным условиям, сопровождающейся, как правило, изменениями деградационного характера: потерей способности взаимодействовать с O2, утратой некоторых компонентов переноса электронов, большей зависимостью от готовых органических соединений среды обитания и т. д. Примером могут служить строго анаэробные эубактерии, составляющие основную микрофлору рубца и пищеварительного тракта животных и человека. Это в большинстве грамотрицательные кокки или палочки, способные сбраживать сахара и/или аминокислоты. У многих из них обнаружены цитохромы b и a и показана способность синтезировать АТФ по механизму мембранзависимого фосфорилирования.
В представленном в этой главе материале проанализированы энергетические процессы, сформированные на первом этапе эволюции жизни на Земле. То, что брожение — наиболее примитивный способ получения энергии организмами, в настоящее время никем не ставится под сомнение. Гораздо сложнее оценить, какой путь в процессе эволюции пройден теми или иными организмами. Очевидно, что при имеющихся возможностях обмена генетической информацией в мире прокариот сохранение их в первоначальном виде маловероятно. Описание представленных в этой главе нескольких групп анаэробных эубактерий, в первую очередь, пропионовокислых бактерий и клостридиев, служит иллюстрацией этого.
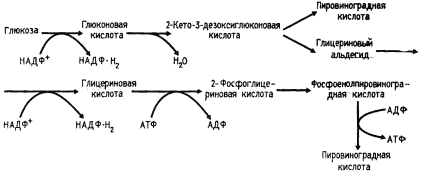
Рис. 67
17. Понятие о ферментах. Их значение и классификация.
Ферменты (от лат. fermentum - брожение, закваска), специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов. Через их посредство реализуется генетическая информация и осуществляются все процессы обмена веществ и энергии в живых организмах. Ферменты бывают простыми или сложными белками, в состав которых наряду с белковым компонентом (апоферментом) входит небелковая часть - кофермент. Эффективность действия ферментов определяется значительным снижением энергии активации катализируемой реакции в результате образования промежуточных фермент-субстратных комплексов. Присоединение субстратов происходит в активных центрах, которые обладают сходством только с определенными субстратами, чем достигается высокая специфичность (избирательность) действия ферментов. Одна из особенностей ферментов - способность к направленному и регулируемому действию. За счёт этого контролируется согласованность всех звеньев обмена веществ. Эта способность определяется пространственность структурной молекулы ферментов. Она реализуется через изменение скорости действия ферментов и зависит от концентрации соответствующих субстратов и кофакторов, рH среды, температуры, а также от присутствия специфических активаторов и ингибиторов (например, адениловых нуклеотидов, карбонильных, сульфгидрильных соединений и др.). Некоторые ферменты помимо активных центров имеют дополнительные, т.н. аллостерические регуляторные центры. Биосинтез ферментов находится под контролем генов. Различают конститутивные ферменты, постоянно присутствующие в клетках, и индуцируемые ферменты, биосинтез которых активируется под влиянием соответствующих субстратов. Некоторые функционально взаимосвязанные ферменты образуют в клетке структурно организованные полиферментные комплексы. Многие ферменты и ферментные комплексы прочно связаны с мембранами клетки или е органоидов (митохондрий, лизосом, микросом и т.д.) и участвуют в активном транспорте веществ через мембраны.
Известно более 20000 различных ферментов, из которых многие выделены из живых клеток и получены в индивидуальном состоянии. Первый кристаллический фермент (уреаза) выделен американским биохимиком Д.Самнером в 1926 г. Для ряда ферментов изучена последовательность аминокислот и выяснено расположение полипептидных цепей в трёхмерном пространстве. В лабораторных условиях осуществлен искусственный химический синтез фермента рибонуклеазы. Ферменты используют для количественного определения и получения различных веществ, для модификации молекул нуклеиновых кислот методами генной инженерии, диагностики и лечения ряда заболеваний, а также в ряде технологических процессов, применяемых в лёгкой, пищевой и фармацевтической промышленностях.
Будучи белками, ферменты обладают всеми их свойствами. Вместе с тем биокатализаторы характеризуются рядом специфических качеств, тоже вытекающих из их белковой природы. Эти качества отличают ферменты от катализаторов обычного типа. Сюда относятся термолабильность ферментов, зависимость их действия от значения рН среды, специфичность и, наконец, подверженность влиянию активаторов и ингибиторов.
По первой в истории изучения ферментов классификации их делили на две группы: гидролазы, ускоряющие гидролитические реакции, и десмолазы, ускоряющие реакции негидролитического распада. Затем была сделана попытка разбить ферменты на классы по числу субстратов, участвующих в реакции. В соответствии с этим ферменты классифицировали на три группы. 1. Катализирующие превращения двух субстратов одновременно в обоих направлениях: А+В)С+D. 2. Ускоряющие превращения двух субстратов в прямой реакции и одного в обратной: А+В)С. 3. Обеспечивающие каталитическое видоизменение одного субстрата как в прямой, так и в обратной реакции: А)В.
Одновременно развивалось направление, где в основу классификации ферментов был положен тип реакции, подвергающейся каталитическому воздействию. Наряду с ферментами, ускоряющими реакции гидролиза (гидролазы), были изучены ферменты, участвующие в реакциях переноса атомов и атомных групп (феразы), в изомеризации (изомеразы), расщеплении (лиазы), различных синтезах (синтетазы) и т. д. Это направление в классификации ферментов оказалось наиболее плодотворным, так как объединяло ферменты в группы не по надуманным, формальным признакам, а по типу важнейших биохимических процессов, лежащих в основе жизнедеятельности любого организма. По этому принципу все ферменты делят на 6 классов.
1. Оксидоредуктазы - ускоряют реакции окисления - восстановления. 2. Трансферазы - ускоряют реакции переноса функциональных групп и молекулярных остатков. 3. Гидролазы - ускоряют реакции гидролитического распада. 4. Лиазы - ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи). 5. Изомеразы - ускоряют пространственные или структурные перестройки в пределах одной молекулы. 6. Лигазы - ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей. Эти классы и положены в основу новой научной классификации ферментов.
18. Участие микроорганизмов в круговороте веществ
В соответствии со своей ролью и функцией в балансе природы организмы разделяются на три группы. Зеленые растения синтезируют органические вещества, используя энергию солнца и углекислоту, поэтому их называют продуцентами. Животные являются потребителями (коису-ментами); они расходуют значительную часть первичной биомассы для построения своего тела. Тела животных и растений в конце концов подвергаются разложению, при котором органические вещества превращаются в минеральные, неорганические соединения. Этот процесс, называемый минерализацией, осуществляют в первую очередь грибы и бактерии; в балансе природы они служат деструкторами. Таким образом, биоэлементы участвуют в циклических процессах. Здесь уместно коротко остановиться на биогеохимических круговоротах углерода, азота, фосфора и серы.
Круговорот углерода. В круговороте углерода микроорганизмы выполняют функцию, очень важную для поддержания жизни на Земле. Они обеспечивают минерализацию углерода, переведенного зелеными растениями в органические соединения, и тем самым поддерживают весьма неустойчивое равновесие (рис. 1.1). Атмосферный воздух содержит чуть больше 0,03% двуокиси углерода (12 мкМ/л). Фотосинтетиче екая же продуктивность зеленых растений так велика, что запас С02 в атмосфере был бы исчерпан примерно за 20 лет. Это относительно короткий срок в человеческих масштабах времени; ведь считается, что запасов энергии и угля на Земле хватит на срок от 1000 до 3000 лет. Даже если учесть запасы С02 в океанах, то этого газа хватило бы лишь примерно на 2000 лет.
Зеленым растениям пришлось бы вскоре прекратить фиксацию С02, если бы низшие животные и микроорганизмы не обеспечивали возвращение этого газа в атмосферу в результате непрерывной минерализации органического материала. В общем балансе веществ на земном шаре почвенным бактериям и грибам принадлежит не меньшая роль, чем фо-тосинтезирующим зеленым растениям. Взаимозависимость всех живых существ на Земле находит наиболее яркое выражение в круговороте углерода.
Рис. 1.1. Круговорот углерода в биосфере.
Круговорот азота (рис. 1.2). Центральное место в круговороте азота занимает аммоний. Он является продуктом разложения белков и аминокислот, попадающих вместе с остатками животного и растительного происхождения в почву. В хорошо аэрируемых почвах аммоний подвергается нитрификации; бактерии родов Nitrosomonas и Nitrobacter окис ляют его до нитрита и нитрата. В качестве источника азота растения могут использовать и ассимилировать как аммоний, так и нитрат. В отсутствие кислорода из нитрата рбразуется молекулярный азот (денитри-фикация). Бактерии, участвующие в этом процессе, используют при этом нитрат в качестве окислителя (акцептора водорода), т.е. «дышат» с помощью NO^ вместо 02; в этом случае говорят о «нитратном дыхании». Денитрификация ведет к потере азота почвой. Наряду с этим бактерии способны и к фиксации молекулярного азота. Связывающие азот бактерии живут или свободно в почве (вне симбиоза), или в симбиозе с высшими растениями (симбиотические азотфиксаторы). Основную роль в круговороте азота наряду с животными и растениями играют бактерии.
Рис. 1.2. Круговорот азота.
Круговорот фосфора. В биосфере фосфор представлен почти исключительно в виде фосфатов. В живых организмах фосфорная кислота существует в форме эфиров. После отмирания клеток эти эфиры быстро разлагаются, что ведет к освобождению ионов фосфорной кислоты. Доступной для растений формой фосфора в почве служат свободные ионы ортофосфорной кислоты (Н3Р04). Их концентрация часто очень низка; рост растений, как правило, лимитируется не общим недостатком фосфата, а образованием малорастворимых его соединений, таких как апатит и комплексы с тяжелыми металлами. Запасы фосфатов в месторождениях, пригодных для разработки, велики, и в обозримом будущем производство сельскохозяйственной продукции не будет ограничиваться недостатком фосфора; однако фосфат должен быть переведен в раство римую форму. Во многих местах фосфат из удобрений попадает в проточные водоемы и озера. Так как концентрация ионов железа, кальция и алюминия в водоемах невысока, фосфат остается в растворенной форме, что приводит к эвтрофизации водоемов, особенно благоприятной для развития азотфиксирующих цианобактерий. В почвах же из-за образования нерастворимых солей фосфаты чаще всего быстро становятся недоступными для усвоения.
Круговорот серы (рис. 1.3). В живых клетках сера представлена главным образом сульфгидрильными группами в серусодержащих аминокислотах (цистеин, метионин, гомоцистеин). В сухом веществе организмов доля серы составляет 1%. При анаэробном разложении органических веществ сульфгидрильные группы отщепляются десульфуразами; образование сероводорода при минерализации в анаэробных условиях называют также десульфурированием. Наибольшие количества встречающегося в природе сероводорода образуются, однако, при диссими-ляционном восстановлении сульфатов, осуществляемом сульфатредуци-рующими бактериями.
Этот сероводород, образующийся в отсутствие молекулярного кислорода в осадках водоемов, может быть окислен анаэробными фото-трофными бактериями (Chromatiaceae) до серы и сульфата. Когда сероводород проникает в зоны, содержащие 02, он окисляется либо абиотическим образом, либо аэробными серобактериями до сульфата . Серу, необходимую для синтеза серусодержащих аминокислот, растения и часть микроорганизмов получают путем ассимиляционной сульфатредукции; животные же получают восстановленные соединения серы с пищей.
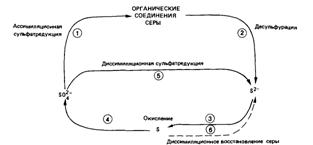
Рис. 1.3. Круговорот серы.
19. Общие принципы регуляции синтеза ферментов.
Регулирование конечным продуктом активности аллостерического фермента определенного биосинтетического пути обеспечивает мгновенную реакцию, приводящую к изменению выхода этого продукта. Если последний оказывается ненужным, отпадает надобность и в ферментах, участвующих в его синтезе. Проявлением максимальной экономичности клеточного метаболизма служат выработанные клеткой механизмы, регулирующие ее ферментный состав. Очевидна целесообразность синтеза только тех ферментов, которые необходимы в конкретных условиях. Показано, что у прокариот в одних условиях фермент может содержаться в количестве не более 1 — 2 молекул, в других — составлять несколько процентов от клеточной массы.
Количество определенного фермента в клетке может регулироваться на нескольких уровнях: на этапе транскрипции, трансляции, а также в процессе сборки и разрушения ферментного белка (см. рис. 28). В иерархии регуляторных воздействий наиболее сложный механизм, контролирующий количество ферментов в клетке, связан с процессом транскрипции. Специфические химические сигналы могут инициировать или блокировать транскрипцию определенного участка ДНК в иРНК. В случае индукции образованная иРНК участвует в определенной последовательности реакций, называемой трансляцией и заканчивающейся синтезом полипептидных цепей. Регуляция белкового синтеза на уровне трансляции может осуществляться на любом из ее этапов, например на этапе инициации, элонгации и др. Не исключена также возможность изменения времени жизни иРНК. под воздействием разных эффекторов, в том числе конечных продуктов метаболических путей. Хотя механизмы регуляции синтеза белка на уровне трансляции еще точно не установлены, ясно, что на этом этапе имеются широкие возможности для регуляции скорости синтеза различных белков.
Известно, что фермент может выполнять метаболическую функцию после приобретения соответствующей структуры. Скорость образования структур высшего порядка также находится под контролем определенных молекул. Таким образом, контроль на уровне сборки функционально активного фермента может играть существенную роль в метаболической регуляции. Наконец, скорость разрушения фермента под воздействием специфических метаболических сигналов будет также определять его концентрацию в клетке.
Регуляция синтеза ферментов на этапе транскрипции основана на том, что "считывание" бактериальных генов происходит избирательно и скорость образования копий соответствующих иРНК (а отсюда и дальнейшая их трансляция в белки) находится под сложным контрольным механизмом. Скорость синтеза ферментов, определяемая этой стадией, может меняться в разной степени. По данному признаку все ферменты делятся на два класса. Ферменты, синтез которых в растущей клетке происходит с постоянной скоростью в результате постоянного транскрибирования соответствующих генов и, следовательно, они присутствуют в клетке в более или менее постоянной концентрации, называются конститутивными. К ним относятся, например, гликолитические ферменты. Метаболические пути, функционирующие с участием конститутивных ферментов, контролируются посредством других регуляторных воздействий, например аллостерического ингибирования.
Кроме этого в бактериальных клетках имеются ферменты, количества которых могут резко меняться в зависимости от состава питательных веществ среды. Это происходит в результате того, что гены, детерминирующие эти ферменты, включаются или выключаются по мере надобности. Их называют индуцибельными. При отсутствии в среде субстратов этих ферментов последние содержатся в клетке в следовых количествах. Если в среду добавить вещество, служащее субстратом определенного фермента, происходит быстрый синтез этого фермента в клетке, т. е. имеет место индукция синтеза фермента. Если же в питательной среде в готовом виде содержится вещество, являющееся конечным продуктом какого-либо биосинтетического пути, происходит быстрое прекращение синтеза ферментов этого пути. Это явление получило название репрессии конечным продуктом. Ферменты, синтез которых подавляется конечным продуктом, могут быть дерепрессированы, т. е. скорость их синтеза превысит обычную, если концентрация конечного продукта упадет до очень низкого уровня. Дерепрессия этих ферментов аналогична явлению индукции.
Репрессия конечным продуктом. Все биосинтетические пути находятся под контролем механизма репрессии конечным продуктом. Точно так же образование большинства анаболических ферментов регулируется путем репрессии их синтеза. Репрессия осуществляется особыми присутствующими в клетке веществами — репрессорами. Факторами, модифицирующими активность репрессоров, могут быть конечные продукты биосинтетических путей, а также промежуточные продукты некоторых катаболических или амфиболических путей.
Репрессия может быть координированной, т. е. синтез каждого фермента данного пути в одинаковой степени подавляется конечным продуктом. Часто синтез ферментов одного пути репрессируется в разной степени. В разветвленных биосинтетических путях механизмы репрессии могут быть модифицированы (как и механизмы ингибирования), чтобы лучше обеспечить регуляцию нескольких конечных продуктов из общего исходного субстрата. Синтез многих ферментов в таких путях репрессируется только при совместном действии всех конечных продуктов. Если реакция на общем участке разветвленного пути катализируется изоферментами, синтез каждого из них находится под контролем "своего" конечного продукта.
Механизм репрессии конечным продуктом на уровне транскрипции стал проясняться с 50-х гг. Большой вклад в это внесли работы Ф. Жакоба и Ж. Моно. Было показано, что наряду со структурными генами, кодирующими синтез ферментов, в бактериальном геноме существуют специальные регуляторные гены. Один из них — ген-регулятор (ген R), функция которого заключается в регуляции процесса транскрипции структурного гена (или генов). Ген-регулятор кодирует синтез специфического аллостерического белка-репрессора, имеющего два центра связывания: один узнает определенную последовательность нуклеотидов на участке ДНК, называемом оператором (ген О), другой — взаимодействует с эффектором. Ген-оператор расположен рядом со структурным геном (генами) и служит местом связывания репрессора. В отличие от операторных генов гены-регуляторы расположены на некотором расстоянии от структурных генов (продукты регулярных генов — репрессоры являются свободно диффундирующими белковыми молекулами).
Часто структурные гены, относящиеся к одному биохимическому пути, объединены в группу, составляющую вместе с оператором единицу транскрипции и регуляции — оперон. Все структурные гены, объединенные в оперон, имеют один операторный участок, локализованной на краю оперона, и координирование регулируются одним репрессором. Оперон представляет собой весьма рациональную и эффективную систему регуляции метаболического пути.
Индукция синтеза ферментов. В большинстве случаев регуляция путем индукции характерна для катаболических путей, где в качестве индукторов выступают обычно субстраты этих путей. Классический пример индуцибельного фермента — (3-галактозидаза Е. coli. Оказалось, что если клетки Е. coli выращивать в среде, содержащей глюкозу, то они не могут использовать лактозу. Если такие клетки поместить в среду, где лактоза — единственный источник углерода, после некоторого периода в них происходит интенсивный синтез фермента (3-галактозидазы, катализирующего гидролиз лактозы на D-глюкозу и D-галактозу. С помощью этого фермента Е. coli может теперь использовать лактозу в качестве единственного источника углерода. Если затем клетки, растущие на среде с лактозой, перенести на среду с глюкозой, синтез (3-галактозидазы прекращается.
Изучение индукции (3-галактозидазы у Е. coli позволило установить, что рост клеток на среде с лактозой происходит не в результате отбора мутантов, у которых способность использовать лактозу есть следствие мутации. Способностью синтезировать этот фермент обладают все клетки. Было также показано, что в процессе индукции происходит не активирование уже имеющегося в клетках фермента (З-галактозидазы, а его синтез de novo из аминокислот.
20. Характеристика химического состава белков.
Изучая химический состав белков, необходимо выяснить, во-первых, из каких химических элементов они состоят, во-вторых, - строение их мономеров. Для ответа на первый вопрос определяют количественный и качественный состав химических элементов белка. Химический анализ показал наличие во всех белках углерода (50-55%), кислорода (21-23%), азота (15-17%), водорода (6-7%), серы (0,3-2,5%). В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах. Содержание основных химических элементов в белках может различаться, за исключением азота, концентрация которого характеризуется наибольшим постоянством и в среднем составляет 16%.
Кроме того, содержание азота в других органических веществах мало. В соответствии с этим было предложено определять количество белка по входящему в его состав азоту. Зная, что 1г азота содержится в 6,25 г белка, найденное количество азота умножают коэффициент 6,25 и получают количество белка.
Для определения химической природы мономеров белка необходимо решить две задачи: разделить белок на мономеры и выяснить их химический состав.
Расщепление белка на его составные части достигается с помощью гидролиза - длительного кипячения белка с сильными минеральными кислотами (кислотный гидролиз) или основаниями (щелочной гидролиз). Наиболее часто применяется кипячение при 110 градусах Цельсия с HCl в течение 24 ч. На следующем этапе разделяют вещества, входящие в состав гидролизата. Для этой цели применяют различные методы, чаще всего - хроматографию.
Главным частью разделенных гидролизатов оказываются аминокислоты. Белки являются одними из четырех основных органических веществ живой материи (белки, нуклеиновые кислоты, углеводы, жиры), но по своему значению и биологическим функциям они занимают в ней особое место. Около 30% всех белков человеческого тела находится в мышцах, около 20% - в костях и сухожилиях и около 10% - в коже.
Но наиболее важными белками всех организмов являются ферменты, которые, холя и присутствуют в их теле и в каждой клетке тела в малом количестве, тем не менее управляют рядом существенно важных для жизни химических реакций.
21. Характеристика форм покоя у бактерий.
Хорошо известно, что при попадании в неблагоприятные условия, многие бактерии способны переходить в покоящееся состояние. Это состояние характеризуется резким снижением метаболической, активности и полным» отсутствием деления. Ранее покоящееся состояние микроорганизмов связывали только со специализированными формами (спорами и цистами), образуемыми ограниченным числом бактерий. Однако сейчас становится ясно, что многие неспорулирующие; бактерии, в том числе и патогенные микроорганизмы, в определенных условиях могут переходить в покоящееся состояние, оставаясь при этом жизнеспособными. Под. покоящимся состоянием' мы понимаем такое, обратимое состояние бактериальной клетки, при котором уровень метаболической активности значительно снижен, а клетка может существовать в таком состоянии без деления длительное время.Такие покоящиеся клетки, как правило, изменяют свою форму, утолщают клеточную стенку и становятся менее чувствительными:к агрессивным внешним воздействиям. И; хотя обычные микробиологические: методы зачастую не могут выявить микроорганизмы, находящиеся в покоящемся состоянии, такие бактерии при наступлении благоприятных условий способны продолжить рост.
До недавнего времени существование покоящегося состояния для микобактерий in vitro или in vivo не было установлено, хотя для ряда других неспорулирующих бактерий переход в покоящееся состояние экспериментально установлен.
Основные признаки анабиотического или покоящегося состояния: 1) отсутствие или предельно заторможенный метаболизм, 2) сохранение структуры в течение продолжительного времени, 3) отсутствие в жидкой фазе заметных количеств свободной воды как непрерывной среды, 4) повышенная устойчивость против экстремальных факторов неделящееся, 5) способность восстанавливать процессы жизнедеятельности.
Очевидно, что переход в покоящееся состояние может происходить под влиянием различных факторов и наряду с универсальными чертами обладать какими-то особенностями и уникальными механизмами регуляции.
Кейлин объединил под названием гипобиоз любое неактивное неделящееся состояние жизнеспособного организма. В свою очередь, гипобиоз включает гипометаболизм и аметаболизи (или латентную жизнь). Гипометаболизм характеризуется крайне низкими, но все же измеряемыми, метаболическими активностями, примером его может служить зимняя спячка животных. Аметаболизм - полное отсутствие какого-либо метаболизма, например, в спорах.
Для бактерий выделяют конститутивное (эндогенное) и экзогенное покоящиеся состояния . Специализированные покоящиеся формы микроорганизмов, такие как споры и цисты, относятся к первому состоянию. Экзогенное состояние покоя наступает под действием неблагоприятных факторов, при этом вегетативные неспорулирующие бактерии могут переходить в неактивное состояние.
22. Характеристика водорастворимых витаминов
Тиамин (витамин В,)
Рибофлавин (витамин В2)
Пантотеновая кислота (витамин В3)
Никотиновая кислота (витамин В5, РР)
Пиридоксин (витамин В6)
Цианкобаламин (витамин В12)
Пангамовая кислота (витамин В15)
Аскорбиновая кислота (витамин С)
Цитрин (витамин Р)
Биотин (витамин Н)
Парааминобензойная кислота Фолиевая кислота
Инозит S-Метилметионин (витамин U)
Характерным для этой группы витаминов является хорошая растворимость в воде и нерастворимость в жирах и органических растворителях.
Как правило, витамины, растворимые в воде, содержатся в продуктах растительного происхождения; большинство из них в своем составе содержит азот. В отличие от жирорастворимых витаминов они не накапливаются в животном организме и проявляют свое биологическое действие, входя в состав ферментов.
Витамин В, (тиамин) является первым витамином, химический состав которого был подробно изучен. Название "тиамин" он получил благодаря наличию в его молекуле серы и азота:
Отсутствие в пище витамина В, вызывает тяжелое заболевание полиневрит, или бери-бери, распространенное в странах, где основным продуктом питания населения служит полированный рис.
По химической природе витамин В2 представляет собой производное азотистого основания — изоаллоксазина, связанное с остатком спирта — рибитола:
При отсутствии витамина В2 у животных наблюдается задержка роста, у человека — выпадение волос. Характерным признаком авитаминоза В2 является заболевание глаз, сопровождающееся вас-куляризаиией роговицы (прорастание кровеносными сосудами). Затем происходит воспаление роговицы и помутнение хрусталика.
Витамин В3 (пантотеновая кислота). При изучении условий, необходимых для роста дрожжей, в рисовых отрубях было открыто вещество, которое оказалось фактором роста. Оно было названо пантотеновой кислотой (от греч. pamothen — везде присутствующий). Такое название витамин В3 получил за свое широкое распространение в природе.
Отсутствие пантотеновой кислоты в пище вызывает ряд расстройств в организме человека: нарушается деятельность сердца, нервной системы, почек, пищевого канала, развиваются дерматиты, обесцвечиваются волосы, снижается аппетит и т. д.
Витамин В5, РР (никотиновая кислота).
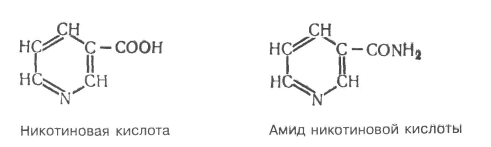
Биологическое значение витамина РР заключается'в том, что он является составной частью коферментов НАД и НАДФ. Последние входят в состав многих дегидрогеназ ферментов, катализирующих реакции биологического окисления. Эту функцию ферменты (их известно около 100) выполняют благодаря наличию в составе их молекул витамина РР, способного обратимо присоединять атомы водорода.
Витамин В6 (пиридоксин).
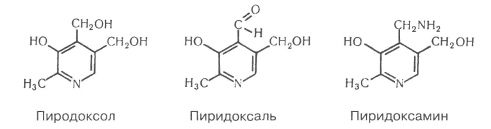
Биологической активностью обладают пиридоксаль и пиридоксамин, образующиеся из пиридоксола, который в связи с этим можно рассматривать скорее как провитамин В6.
В организме пиридоксаль и пиридоксамин легко превращаются в фосфорилированную форму, образуя пиридоксальфосфат и пи-ридоксаминфосфат:
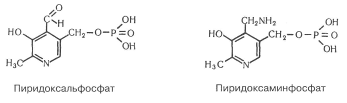
Биологическая роль витамина В6 состоит в том, что он является коферментом так называемых трансаминаз или аминотранс-фераз. Это ферменты, участвующие в белковом обмене, в реакциях превращений а-аминокислот.
Витамин В12 (цианкобаламин).
Следует подчеркнуть, что цианкобаламин единственный известный в настоящее время витамин, содержащий в" своей молекуле металл и практически не образующийся ни в растениях, ни в тканях животных.
Витамин В12 синтезируется главным образом микроорганизмами, в том числе обитающими в кишках человека. Очень богаты этим витамином стоячие и сточные воды, почва, ил. Живущие в них анаэробные бактерии отличаются высоким содержанием витамина В12.
Витамин Ви (пангамовая кислота) принадлежит к числу недавно открытых витаминов. По химическому строению пангамовая кислота представляет собой эфир D-глюконовой и диметила-миноуксусной кислот:
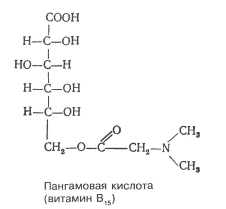
Витамин С (аскорбиновая кислота). По своему химическому строению аскорбиновая кислота близка к углеводам гексозам.
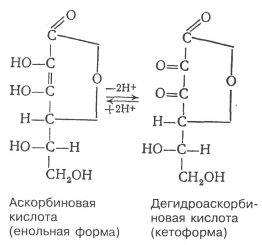
23. Характеристика жирорастворимых витаминов. Их значение.
Ретинолы и каротиноиды (витамины группы А)
Кальциферолы (витамины группы D)
Токоферолы (витамины группы Е)
Филохиноны (витамины группы К)
Жирорастворимые витамины нерастворимы в воде, но растворяются в органических растворителях. Они термостабильны, устойчивы к изменению рН среды. Особенностью всех жирорастворимых витаминов является их способность всасываться в кишках только в присутствии жиров, а также иногда накапливаться в организме в больших количествах, вызывая гипервитаминозы.
Жирорастворимые витамины выполняют ряд функций: способствуют формированию, росту и развитию эмбрионов, образованию и регенерации костной и эпителиальной тканей, свертыванию крови.
С химической точки зрения они имеют.одну общую особенность: в состав их молекулы входят строительные блоки изопренового типа, что наиболее ярко выражено в молекулах витаминов А, Е и К, которые составлены из изопреновых единиц
Витамин А содержится только в животных тканях. Растения лишены этого витамина, однако они содержат группу веществ, которые в организме млекопитающих служат предшественниками витамина А — каротиноиды. Они довольно широко распространены в природе. Каротинами богат стручковый перец, красная и кормовая морковь, зеленый клевер, абрикосы.
Различают а-, р- и у- каротины, среди которых наиболее ценными в биологическом отношении являются Р-каротины.
В группу витамина А входит несколько витаминов, основным из которых является витамин А, (ретинол):
Витамин D. Известно несколько витаминов группы D (D2, D3, D4, D5, D6, D7), имеющих сходное строение. Наибольшей биологической активностью обладают витамины D2 (эргокальциферол) и D3 (холекальциферол). Витамины группы D содержатся главным образом в организме человека и животных.
В последнее время получено много данных, свидетельствующих о том, что функция витамина D не ограничивается только регулированием обмена кальция и фосфора, а более многогранна. Витамин D активирует деятельность фермента щелочной фос-фатазы в очагах окостенения и тем самым способствует образованию костной ткани.
Витамин D оказывает стимулирующее действие на синтез белка, связывающего кальций, и ДНК-зависимый синтез РНК, что положительно отражается на биосинтезе белков-переносчиков, ответственных за всасывание кальция. Он способствует реабсорбции фосфатов, аминокислот и ионов Са2+ из первичной мочи в плазму крови, усиливает реакции окисления углеводов, пировиноградной кислоты, а также ускоряет реакции цикла трикарбоновых кислот.
Витамин Е представлен целой группой витаминов, содержащихся в больших количествах в растительных маслах и называемых токоферолами. Отсутствие этих витаминов в пище отрицательно сказывается на способности организма к размножению. Поэтому витамин Е называется также антистерильным витамином, или витамином размножения.
Наиболее высокой биологической активностью обладает а-токоферол следующего строения:
а-Токоферол триметилгидрохинон, соединенный с остатком спирта фитола. В настоящее время известно несколько витаминов группы К. Все они обладают сходной структурой и общим названием — филлохиноны. Наиболее активным из этой группы является витамин К,, выделенный из люцерны:
24. Особенности строения и значение нуклеиновых кислот
Нуклеиновые кислоты (ДНК и РНК) относятся к сложным высокомолекулярным соединениям, состоят из небольшого числа индивидуальных химических компонентов более простого строения. Так, при полном гидролизе нуклеиновых кислот (нагревание в присутствии хлорной кислоты) в гидролизате обнаруживают пуриновые и пиримидиновые основания, углеводы (рибоза и дезоксирибоза) и фосфорную кислоту :

В молекуле ДНК углевод представлен дезоксирибозой, а в молекуле РНК – рибозой, отсюда их названия: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК) кислоты. Кроме того, они содержат фосфорную кислоту, по два пуриновых и по два пиримидиновых основания; различия только в пиримидиновых основаниях: в ДНК содержится тимин, а в РНК – урацил. В составе ДНК и РНК открыты так называемые минорные (экзотические) азотистые основания (строение некоторых из них приводится далее).
Углеводы (рибоза и дезоксирибоза) в молекулах ДНК и РНК находятся в β-D-рибофуранозной форме:
В составе некоторых фаговых ДНК обнаружена молекула глюкозы, которая соединяется гликозидной связью с 5-оксиметилцитозином.
Основу структуры пуриновых и пиримидиновых оснований составляют два ароматических гетероциклических соединения – пиримидин и пурин :
Молекула пурина состоит из двух конденсированных колец: пиримидина и имидазола.
В составе нуклеиновых кислот встречаются три главных пиримидиновых основания: цитозин, урацил и тимин.
Помимо главных пиримидиновых оснований, в составе нуклеиновых кислот открыты минорные пиримидиновые основания, 5-метил- и 5-окси-метилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, оротовая кислота, 5-карбоксиурацил, 4-тиоурацил и др. Забегая несколько вперед, укажем, что только для тРНК список минорных оснований приближается к 50. На долю минорных оснований приходится до 10% всех нуклеотидов тРНК, что имеет, очевидно, важный физиологический смысл (защита молекулы РНК от действия гидролитических ферментов). Структурные формулы ряда минорных пиримидиновых оснований представлены в форме нуклеозидов – соединений с углеводным компонентом:
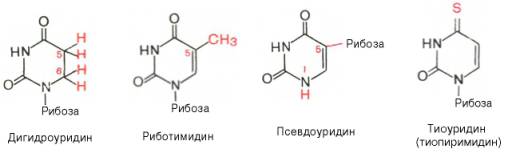
Два пуриновых основания, постоянно встречающихся в гидролизатах нуклеиновых кислот, имеют следующее строение:
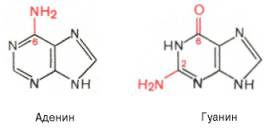
К минорным нуклеозидам пуринового ряда, обнаруживаемым в составе ДНК и РНК, относятся инозин, N6-метиладенозин, N2-метилгуанозин, ксантин, гипоксантин, 7-метилгуанозин и др.
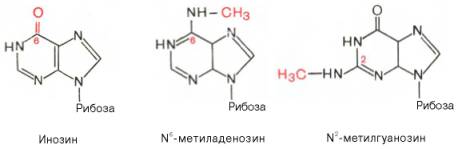
Одним из важных свойств свободных азотистых оснований (содержащих оксигруппы) является возможность их существования в двух таутомерных формах, в частности лактим- и лактамной формах, в зависимости от значения рН среды: при рН 7,0 они представлены в лактамной форме, при снижении величины рН – в лактимной форме. Таутомерные превращения можно представить на примере урацила.
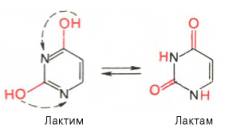
Оказалось, что в составе природных нуклеиновых кислот все оксипроиз-водные пуринов и пиримидинов находятся в лактамной форме.
О локализации и количественном содержании нуклеиновых кислот в клетках получены определенные данные. Доказано, что количественное содержание ДНК в клетках одного и того же организма отличается удивительным постоянством и исчисляется несколькими пикограммами, однако в клетках разных видов живых организмов имеются существенные количественные различия в содержании ДНК. Хорошо известно также, что ДНК преимущественно сосредоточена в ядре, а в митохондриях и хлоро-пластах содержится только небольшой процент клеточной ДНК. О количестве РНК нет точных данных, поскольку содержание ее в разных клетках в значительной степени определяется интенсивностью синтеза белка. На долю РНК приходится около 5–10% от общей массы клетки. Современная классификация различных типов клеточной РНК основывается на данных топографии, функции и молекулярной массы. Выделяют три главных вида РНК: матричную (информационную) – мРНК, которая составляет 2–3% от всей клеточной РНК; рибосомную – рРНК, составляющую 80–85% и транспортную – тРНК, которой около 16%. Эти 3 вида различаются нуклеотид-ным составом и функциями.
Матричная РНК (мРНК) синтезируется в ядре на матрице ДНК, затем поступает в рибосому, выполняя матричную функцию при синтезе белка. По предположению акад. А.С. Спирина, часто мРНК при поступлении из ядра в цитоплазму образует со специфическими РНК-свя-зывающими белками комплексы – так называемые информосомы, способные к обратимой диссоциации. Информосомы рассматриваются как транспортная форма мРНК, способствующая образованию полирибосом в цитоплазме. Транспортные РНК (тРНК) имеют небольшую молекулярную массу и содержатся в растворимой фракции цитоплазмы, выполняя функцию переноса аминокислот к месту белкового синтеза – рибосоме. Рибосом-ные РНК (рРНК), как видно из данных табл. 3.1, имеют разную и значительно большую молекулярную массу. Они локализуются в двух субчастицах рибосом 50S и 30S у Е.coli и 60S и 40S в клетках животных (табл. 3.2).
Субчастица 60S содержит три разных рРНК (5S, 5,8S и 28S рРНК), в то время как субчастица 40S – одну молекулу 18S рPHK. Детально роль рРНК в белковом синтезе пока не выяснена.
Для понимания ряда особенностей структуры ДНК важное значение имели закономерности состава и количественного содержания азотистых оснований, установленные впервые Э. Чаргаффом. Оказалось, что азотистые основания ДНК обычно варьируют у разных видов организмов, однако почти не претерпевают изменений у одного и того же вида в процессе развития или в зависимости от изменений окружающей среды либо характера питания. Показано также, что ДНК, выделенная из разных тканей одного и того же вида, имеет одинаковый состав азотистых оснований. Полученные количественные соотношения были названы правилами Чар-гаффа. При анализе состава очищенной ДНК, выделенной из разных источников, были сделаны следующие выводы:
1) молярная доля пуринов равна молярной доле пиримидинов:
![]()
2) количество аденина и цитозина равно количеству гуанина и тимина:
![]()
3) количество аденина равно количеству тимина, а количество гуанина равно количеству цитозина: А = Т и Г = Ц; соответственно
![]()
4) существенным для характеристики вида (таксономическое значение) оказался так называемый коэффициент специфичности, отражающий отношение
![]()
Это отношение часто выражают в молярных процентах (Г + Ц), или процентах ГЦ-пар. Для животных и большинства растений этот коэффициент ниже 1 (от 0,54 до 0,94), у микроорганизмов он колеблется в значительных пределах (от 0,45 до 2,57).
Литература
1. Прокариотические и эукариотические клетки (Т.А. Козлова, В.С. Кучменко. Биология в таблицах. М.,2000).
2. Б.Албертс, Д.Брей, Дж.Льюис, М.Рэфф, К.Робертс, Дж.Уотсон. "Молекулярная биология клетки", 2-е издание, "Мир", 1994.
3. С.Бейкер. Камень преткновения.Верна ли теория эволюции? – М., «Протестант», 1992.
4. Гилберт С. Биология развития 3 томам., "Мир", 1993г.
5. Грин Н., Стаут У., Тейлор Д., Биология 3 тома, М, "Мир", 1990г.
6. Дубинин Н.П. Новое в современной генетики М, "Наука", 1989г.
© 2010 Интернет База Рефератов