
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Курсовая работа: Анализ почв и агрохимический анализ
Курсовая работа: Анализ почв и агрохимический анализ
Содержание
1. Введение. Агрономическая химия
2. Агрономический анализ
А) Анализ почв
1)Особенности почвы, как объекта анализа
2)Система показателей хим. состава почв
3)Принципы определения и интерпретации
4)Подготовка проб почв с исследуемого участка
5)Подготовка почвы к анализу
6)Получение водного раствора почв
7)Методы количественного анализа вытяжек
8)Методика определения. Кислотность почв
9)Определение рН, обменной кислотности и подвижного Al по Соколову
10)Методы определения приоритетных загрязняющих веществ
Б) Анализ растений
1)Отбор растительной пробы
2)Фиксирование растительных материалов
3)Размол и хранение
4)Определение различных веществ в растительных материалах
5)Определение общего азота по Кьельдалю
В) Анализ удобрений
1)Определение видов и форм некоторых минеральных удобрений по качественным реакциям
2)Определение в удобрениях содержания аммиачного азота методом открытого кипячения
Заключение
Список цитируемой литературы
1 ВВЕДЕНИЕ. АГРОНОМИЧЕСКАЯ ХИМИЯ
Агрономическая химия изучает гл. обр. вопросы азотного и минерального питания с.-х. растений с целью повышения урожая и улучшения продукции. Таким образом, а. х. исследует состав с.-х. растений, почвы, удобрений и процессы их взаимного влияния. Равным образом она изучает процессы приготовления удобрений и вещества, употребляемые для борьбы с вредителями, а также разрабатывает методы хим. анализа агрономических объектов: почвы, растений и продуктов, из них получаемых, и пр. Особенно значимы микробиологические процессы почвы. В этой области а. х. соприкасается с почвоведением и общим земледелием. С другой стороны, а. х. опирается на физиологию растений и с ней соприкасается, поскольку а. х. занимается изучением процессов, происходящих при прорастании, питании, созревании семян и пр., и пользуется методами водных, песчаных и почвенных культур. При своих исследованиях агрономы-химики, пользуясь главным образом химическими методами, из которых в последнее время особенно широко применяются физико-химические, в то же время должны владеть методикой искусственных культур и бактериологическими методами исследования. Вследствие сложности и многообразия задач а. х., некоторые группы вопросов, входивших ранее в а. х., выделились в самостоятельные дисциплины. Это относится к химии, изучающей химический состав растений, главным образом с.-х. и технических, а также к биологической химии и биологической физике, изучающим процессы живой клетки.
2 АГРОНОМИЧЕСКИЙ АНАЛИЗ
Агрономический анализ: 1) почвы, 2) растительных веществ, 3) удобрений. А. а. обслуживает опытные с.-х. станции и лаборатории при выработке научных оснований животноводства и растениеводства, контролирует с.-х. производство и переработку продуктов с.-х. Каждый отдел а. а. имеет ряд отдельных методов определения.
I. По анализу почв.
А) Методы валового анализа почвы:
1) определение гигроскопической влаги,
2) общего содержания минеральных веществ,
3) углекислоты,
4) карбонатов,
5) перегноя,
6) азота,
7) химически связанной воды,
8) различные валовые определения минеральной части почвы после разложения почвы фтористоводородной кислотой или сплавлением с углекислыми щелочами.
Б) Анализ солянокислой вытяжки.
В) Анализ водной вытяжки.
II. По анализу растительных веществ:
1) определение гигроскопической влажности,
2) золы,
3) сырого жира,
4) нечистой клетчатки,
5) чистой клетчатки и сопутствующих ей лигнина и кутина,
6) пентозанов,
7) крахмала,
8) общего количества безазотных экстрактивных веществ,
9) растворимых углеводов,
10) тростникового сахара,
11) общего количества азота,
12) белковых веществ — по содержанию белкового азота,
13) азота небелковых веществ:
а) свободного аммиака,
б) амидов кислот (аспарагина и глютамина),
в) аминокислот,
14) нитратного азота. Кроме того, определяются иногда органические вещества растений, а также все минеральные составные части золы растительных веществ.
III. По анализу удобрений детально разработаны методы анализа:
1) фосфорнокислых удобрений,
2) азотных,
3) калийных
4) известковых.
А) Анализ почв
1) Особенности почвы как объекта химического исследования и
показатели химического состояния почв
Почва — сложный объект исследования. Сложность исследования химического состояния почв обусловлена особенностями их химических свойств и связана с необходимостью получения информации, адекватно отражающей свойства почв и обеспечивающей наиболее рациональное решение, как теоретических вопросов почвоведения, так и вопросов практического использования почв. Для количественного описания химического состояния почв используют широкий набор показателей. В него входят показатели, определяемые при анализе практически любых объектов и разработанные специально для исследования почв (обменная и гидролитическая кислотность, показатели группового и фракционного состава гумуса, степень насыщенности почв основаниями и др.)
Особенностями почвы как химической системы является гетерогенность, полихимизм, дисперсность, неоднородность, изменение и динамика свойств, буферность, а так же необходимость оптимизации свойств почвы.
Полихимизм почв. В почвах один и тот же химический элемент может входить в состав разнообразных соединений: легкорастворимых солей, сложных алюмосиликатов, органоминеральных веществ. Эти компоненты обладают разными свойствами, от которых, в частности, зависит способность химического элемента переходить из твердых фаз почвы в жидкую, мигрировать в профиле почвы и в ландшафте, потребляться растениями и т.п. Поэтому в химическом анализе почв определяют не только общее содержание химических элементов, но и показатели, характеризующие состав и содержание индивидуальных химических соединений или групп соединений, обладающих близкими свойствами.
Гетерогенность почв. В составе почвы выделяют твердую, жидкую, газовую фазы. При исследовании химического состояния почвы и отдельных ее компонентов определяют показатели, характеризующие не только почву в целом, но и ее отдельные фазы. Разработаны математические модели, позволяющие оценить взаимосвязь уровней парциального давления диоксида углерода в почвенном воздухе, рН, карбонатной щелочности и концентрации кальция в почвенном растворе.
Полидисперсность почв. Твердые фазы почвы состоят из частиц разного размера от крупинок песка до коллоидных частиц диаметром в несколько микрометров. Они неодинаковы по составу и обладают разными свойствами. При специальных исследованиях генезиса почв определяют показатели химического состава и других свойств отдельных гранулометрических фракций. С дисперсностью почв связана их способность к ионному обмену, которая в свою очередь характеризуется специфическим набором показателей — емкостью катионного и анионного обмена, составом обменных катионов и пр. От уровней этих показателей зависят многие химические и физические свойства почв.
Кислотно-основные и окислительно-восстановительные свойства почв. В состав почв входят компоненты, проявляющие свойства кислот и оснований, окислителей и восстановителей. При решении разнообразных теоретических и прикладных проблем почвоведения, агрохимии, мелиорации определяют показатели, характеризующие кислотность и щелочность почв, их окислительно-восстановительное состояние.
Неоднородность, вариабельность, динамика, буферность химических свойств почв. Свойства почв неодинаковы даже в пределах одного и того же генетического горизонта. При исследовании процессов формирования почвенного профиля оценивают химические свойства отдельных элементов организации почвенной массы. Свойства почв варьируют в пространстве, изменяются во времени и в то же время почвы обладают способностью противостоять изменению своих свойств, т. е. проявляют буферность. Разработаны показатели и способы характеристики вариабельности, динамики, буферности свойств почв.
Изменение свойств почв. В почвах непрерывно протекают разнообразные процессы, которые приводят к изменению химических свойств почв. Практическое применение находят показатели, характеризующие направление, степень выраженности, скорости протекающих в почвах процессов; исследуются динамика изменения свойств почв и их режимы. Разнокачественностъ состава почв. Разные типы и даже виды и разновидности почв могут иметь столь разные свойства, что для их химической характеристики используют не только разные аналитические приемы, но и разные наборы показателей. Так, в подзолистых, дерново-подзолистых, серых лесных почвах, определяют рН водных и солевых суспензий, обменную и гидролитическую кислотность, обменные основания вытесняют из почв водными растворами солей. При анализе засоленных почв определяют рН только водных суспензий, а вместо показателей кислотности общую, карбонатную и другие виды щелочности. Перечисленные особенности почв во многом обусловливают принципиальные основы методов исследования химического состояния почв, номенклатуру и классификацию показателей химических свойств почв и химических почвенных процессов.
2) Система показателей химического состояния почв
Группа 1. Показатели свойств почв и почвенных компонентов
Подгруппы:
1. Показатели состава почв и почвенных компонентов;
2. Показатели подвижности химических элементов в почвах;
3. Показатели кислотно-основных свойств почв;
4. Показатели ионообменных и коллоидно-химических свойств почв;
5. Показатели окислительно-восстановительных свойств почв;
6. Показатели каталитических свойств почв;
Группа 2. Показатели химических почвенных процессов
Подгруппы:
1. Показатели направления и степени выраженности процесса;
2. Показатели скорости процесса.
3) Принципы определения и интерпретации уровней показателей
Результаты анализа почв содержат информацию о свойствах почв и почвенных процессах и на этой основе позволяют решить стоящую перед исследователем задачу. Приемы интерпретации уровней показателей зависят от методов их определения. Эти методы можно разделить на две группы. Методы первой группы позволяют без изменения химического состояния почвы оценить ее свойства. Вторая группа - методы, в основе которых лежит химическая обработка анализируемой почвенной пробы. Цель этой обработки — воспроизвести химические равновесия, которые осуществляются в реальной почве либо заведомо нарушить сложившиеся в почвах взаимосвязи и извлечь из почвы компонент, количество которого позволяет оценить химическое свойство почвы или протекающий в ней процесс. Этот этап аналитического процесса химическая обработка навески почвы — отражает главную особенность метода исследования и обусловливает приемы интерпретации уровней большинства определяемых показателей.
4) Подготовка проб почвы с исследуемых участков
Пробы почвы нужно брать с помощью кернов диаметром около 10 мм на глубину 10- 20 см. Керны лучше предварительно простерилизовать в кипящей воде (1000С). Для проведения анализа почвы отбирают смешанные образцы почвы на глубину окультуриваемого слоя. Как правило, достаточно составить один смешанный образец для участка площадью до 2 га. Смешанный образец составляют из 15-20 индивидуальных почвенных проб, взятых равномерно по всей площади участка. Образцы для анализа почвы не отбирают непосредственно после внесения минеральных и органических удобрений, извести. Каждый смешанный образец массой 500 г. упаковывают в матерчатый или полиэтиленовый мешок и маркируют.
5) Подготовка почвы к агрохимическому анализу
Составление аналитической пробы - ответственная операция, которая обеспечивает надежность полученных результатов. Небрежность и ошибки при подготовке образцов и взятии средней пробы не компенсируются последующей качественной аналитической проработкой. Образцы почвы, отобранные в поле или в вегетационном домике, предварительно подсушивают на воздухе при комнатной температуре. Хранение сырых образцов ведет к значительным изменениям их свойств и состава, особенно в результате ферментативных и микробиологических процессов. Напротив - температурный перегрев сопровождается изменением подвижности и растворимости многих соединений. Если образцов много, то проводится сушка в шкафах с принудительной вентиляцией. Определение нитратов, нитритов, поглощённого аммония, водорастворимых форм калия, фосфора и т.п. проводится в день взятия образцов при их естественной влажности. Остальные определения проводятся в воздушно-сухих образцах. Сухие образцы измельчают на почвенной мельнице или растирают в фарфоровой ступке пестиком с резиновым наконечником. Растёртый и просушенный образец пропускают через сито с диаметром отверстий 2-3 мм. Растирание и просеивание проводят до тех пор, пока весь взятый образец не пройдет через сито. Допускается отброс только обломков камней, крупных корней и инородных включений. Образцы хранятся в закрытых крафтовых пакетах в помещении, где отсутствуют химические реактивы. Навеску почвы для анализа берут методом «средней пробы». Для этого просеянный образец рассыпают тонким слоем (около 0.5 см) на листе бумаги в виде квадрата и делят его шпателем на мелкие квадратики со стороной 2-2.5 см. Из каждого квадратика шпателем отбирают часть образца.
Основными агрохимическими показателями анализа почвы, без которых не обходится ни одно окультуривание земель, являются содержание гумуса, подвижных форм фосфора, азота и калия, кислотность почвы, содержание кальция, магния, а также микроэлементов, в том числе и тяжелых металлов. Современные методы анализа позволяют определить в одной пробе 15-20 элементов. Фосфор относится к макроэлементам. По обеспеченности подвижными фосфатами различают почвы с очень низким содержанием - менее мг., низким - менее 8 мг., средним - 8 - 15 мг. и высоким - более 15 мг. фосфатов на 100 г. почвы.
Калий. Для этого элемента разработаны градации по содержанию в почве подвижных форм: очень низкое - до 4 мг., низкое - 4-8 мг., среднее - 8-12 мг., повышенное - 12-17 мг., высокое - более 17 мг. обменного калия на 100 г. почвы.Кислотность почвы - характеризует содержание протонов водорода в почве. Этот показатель выражают величиной рН. Кислотность почвы оказывает свое влияние на растения не только через непосредственное воздействие на корни растений токсичных протонов водорода и ионов алюминия, но и через характер поступления элементов питания. Катионы алюминия могут связываться с фосфорной кислотой, переводя фосфор в недоступную для растений форму. Негативное действие низкой кислотности отражается и на самой почве. При вытеснении протонами водорода из почвенного поглощающего комплекса (ППК) катионов кальция и магния, стабилизирующих структуру почвы, происходит разрушение гранул почвы и потеря ею оструктуренности.
Различают актуальную и потенциальную кислотность почвы. Актуальная кислотность почвы обусловлена превышением концентрации протонов водорода над ионами гидроксила в почвенном растворе. Потенциальная кислотность почвы включает протоны водорода, находящиеся в связанном состоянии с ППК. Для суждения о потенциальной кислотности почвы определяют рН солевой вытяжки (pH KCl). В зависимости от величины pH KCl различают кислотность почвы: до 4 - очень сильнокислая, 4,1-4,5 - сильнокислая, 4,6-5,0 - среднекислая, 5,1-5,5 - слабокислая, 5,6-6,0 - близкая к нейтральной и 6,0 - нейтральная. Анализ почвы на содержание тяжелых металлов и радиационный анализ относятся к категории редких анализов.
6) Получение водного раствора почв
Растворы веществ, содержащихся в почве, получают многими способами, которые принципиально можно разделить на две группы:-получение почвенного раствора;- получение водной вытяжки из почвы.В первом случае получают несвязанную или слабо связанную почвенную влагу - ту, которая содержится между частицами почвы и в почвенных капиллярах. Это слабо насыщенный раствор, но его химический состав является актуальным для растения, поскольку именно эта влага омывает корни растений и именно в ней идет обмен химическими веществами. Во втором случае вымывают из почвы связанные с ее частицами растворимые химические соединения. Выход соли в водную вытяжку зависит от соотношения почвы и раствора и увеличивается при возрастании температуры экстрагирующего раствора (до определенных пределов, так как слишком высокая температура может разрушить какие-либо вещества или перевести их в иное состояние) и увеличении объема раствора и степени измельченности почвы (до определенных пределов, так как слишком мелкие пылеобразные частицы могут сделать затруднительной или невозможной экстракцию и фильтрацию раствора).Почвенный раствор получают с помощью ряда инструментов: опрессование, центрифугирование, вытеснение несмешивающимся раствором жидкости, вакуум-фильтрационный метод и лизиметрический метод.
Опрессование проводится с образцом почвы, взятым из полевых в лабораторные условия. Чем большее количество раствора необходимо, тем крупнее должен быть образец или выше применяемое давление, или и то, и другое одновременно. Центрифугирование проводится при 60 об/мин в течение длительного времени. Метод малоэффективен, и подходит для образцов почв с влажностью, приближенной к полной возможной влажности данной почвы. Для пересушенной почвы такой способ неприменим. Вытеснение почвенной влаги веществом, не смешивающимся с почвенным раствором, позволяет получить фактически всю влагу почвы, включая капиллярную, без использования сложной техники. В качестве вытесняющей жидкости используется спирт или глицерин. Неудобства в том, что эти вещества, кроме высокой плотности, обладают хорошей экстрагирующей способностью по отношению к некоторым соединениям (например, спирт легко экстрагирует почвенную органику), поэтому можно получить завышенные показатели содержания ряда веществ по сравнению с их реальным содержанием в почвенном растворе. Метод подходит не для всех типов почв.
При вакуум-фильтрационном методе над образцом с помощью вакуума создается разрежение, превышающее уровень натяжения почвенной влаги. При этом не извлекается капиллярная влага, так как силы натяжения в капилляре выше сил натяжения поверхности свободной жидкости.Лизиметрический метод используется в полевых условиях. Лизиметрический метод позволяет не столько оценить гравитационную влагу (то есть влагу, способную к перемещению по почвенным слоям благодаря силе гравитации - за исключением капиллярной влаги), сколько провести сравнение содержания и миграции химических элементов почвенного раствора. Свободная влага почвы фильтруется через толщу почвенного горизонта по гравитационным силам до пробоотборника, расположенного на поверхности почвы.
Для получения более полного представления о химическом составе почвы, готовят почвенную вытяжку. Для ее получения образец почвы измельчают, пропускают через сито с ячейками диаметром 1 мм, добавляют воду в массовом соотношении 1 часть почвы на 5 частей бидистиллированной (очищенной от любых примесей, дегазированной и деионизированной) воды, рН 6.6-6,8, температура 200С. Дегазация проводится для того, чтобы освободить воду от примесей растворенного газообразного углекислого газа, который при соединении с некоторыми веществами дает нерастворимый осадок, снижая точность эксперимента. Примеси других газов также могут оказывать негативное влияние на результаты эксперимента.
Для более точного взвешивания навески следует учитывать ее естественную влажность, полевую (для только что взятого образца) или гигроскопическую (для высушенного и хранившегося образца). Определенную в процентах от массы образца его влажность переводят в массу и суммируют с требуемой массой. Навеска помещается в сухую колбу объемом 500-750 мл, добавляется вода. Колба с образцом почвы и водой плотно закрывается пробкой и встряхивается в течение двух-трех минут. Далее полученный раствор фильтруется через обеззоленный бумажный складчатый фильтр. Важно, чтобы в помещении при этом не было летучих паров кислот (работу предпочтительнее проводить под тягой, где не хранятся растворы кислот). Перед фильтрованием раствор с почвой хорошо взбалтывают, чтобы мелкие частицы почвы закрыли самые крупные поры фильтра и фильтрат получился более прозрачным. Примерно 10 мл начального фильтрата выбрасывается, так как он содержит примеси с фильтра. Фильтрование остальной части первичного фильтрата повторяют несколько раз.
К работе по определению содержания химических веществ в водной вытяжке приступают сразу после ее получения, так как с течением времени происходят химические процессы, изменяющие щелочность раствора, его окисляемость и т.п. Уже скорость фильтрации может показать относительное суммарное содержание солей в растворе. Если водная вытяжка богата солями, то фильтрация будет проходить быстро и раствор получится прозрачным, поскольку соли препятствуют пептизации почвенных коллоидов. В случае если раствор беден солями, фильтрация будет проходить медленно и не очень качественно. При этом имеет смысл отфильтровать раствор несколько раз, несмотря на низкую скорость, т.к. при дополнительных фильтрациях возрастает качество водной вытяжки благодаря снижению содержанию в ней частиц почвы.
7) Методы количественного анализа вытяжек или любых других
полученных в ходе анализа почв растворов
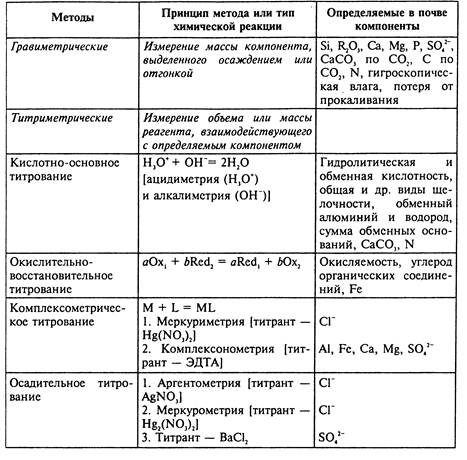
В большинстве случаев интерпретация результатов анализа почв от метода измерения не зависит. В химическом анализе почв может быть использован практически любой из методов, которыми располагают аналитики. При этом измеряется либо непосредственно искомая величина показателя, либо величина, функционально с ней связанная. Основные разделы хим. анализа почв: валовой, или элементный, анализ — позволяет выяснить общее содержание в почве С, N, Si, Al, Fe, Ca, Mg, Р, S, K, Na, Mn, Ti и др. элементов; анализ водной вытяжки (основа исследования засоленных почв) даёт представление о содержании в почве водорастворимых веществ (сульфатов, хлоридов и карбонатов кальция, магния, натрия и др.); определение поглотительной способности почвы; выявление обеспеченности почв питательными веществами — устанавливают количество легкорастворимых (подвижных), усваиваемых растениями соединений азота, фосфора, калия и др. Большое внимание уделяют изучению фракционного состава органических веществ почвы, форм соединений основных почвенных компонентов, в том числе микроэлементов.
В лабораторной практике анализа почв используют классические химические и инструментальные методы. С помощью классических химических методов можно получить наиболее точные результаты. Относительная погрешность определения составляет 0,1-0,2%. Погрешность большинства инструментальных методов значительно выше — 2-5%
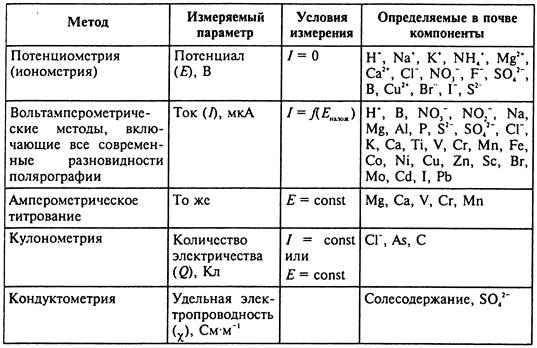
Среди инструментальных методов в анализе почв наиболее широко используются электрохимические и спектроскопические. Среди электрохимических методов находят применение потенциометрические, кондуктометрические, кулонометрические и вольтамперометрические, включающие все современные разновидности полярографии.
Для оценки почвы результаты анализов сравнивают с оптимальными уровнями содержания элементов, установленными экспериментальным путем для данного типа почв и проверенными в производственных условиях, или с имеющимися в литературе данными обеспеченности почв макро- и микроэлементами, либо с ПДК изучаемых элементов в почве. После этого делается заключение о состоянии почвы, даются рекомендации по её использованию, рассчитываются дозы мелиорантов, минеральных и органических удобрений на планируемый урожай.
Классические химические методы анализа
Электрохимические методы анализа
Систематизация и
некоторые особенности спектроскопических методов 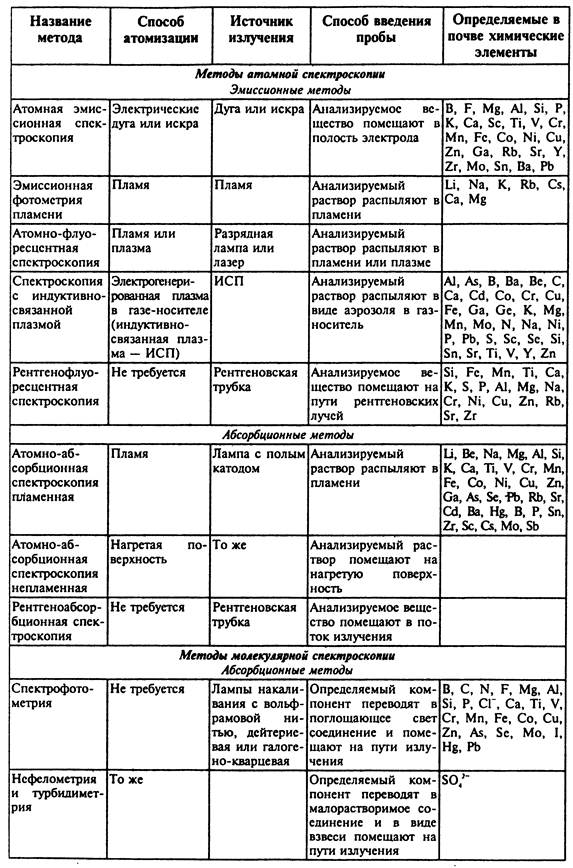
При выборе метода измерения учитываются особенности химических свойств анализируемой почвы, природа показателя, необходимая точность определения его уровня, возможности методов измерения и выполнимость требуемых измерений в условиях проведения эксперимента. В свою очередь, точность измерений обусловливается целью исследования и природной вариабельностью изучаемого свойства. Точность — собирательная характеристика метода, оценивающая правильность и воспроизводимость получаемых результатов анализа.
Соотношение уровней содержания в почвах некоторых химических элементов.

Разные уровни содержания и разные химические свойства элементов не всегда делают целесообразным применение одного и того же метода измерения для количественного определения всего необходимого набора элементов.
В элементном (валовом) анализе почв используют методы с разными пределами обнаружения. Для определения химических элементов, содержание которых превышает десятые доли процента, возможно использование классических методов химического анализа гравиметрических и титриметрических.
Разные свойства химических элементов, разные уровни их содержания, необходимость определения разных показателей химического состояния элемента в почве делают необходимым использование методов измерения с разными пределами обнаружения.
8) Кислотность почв
Определение реакции почв относится к числу наиболее распространенных анализов, как в теоретических, так и в прикладных исследованиях. Наиболее полная картина кислотных и основных свойств почв складывается при одновременном измерении нескольких показателей, в том числе титруемой кислотности или щелочности - фактор емкости и величины рН - фактор интенсивности. Фактор ёмкости характеризует общее содержание кислот или оснований в почвах, от него зависят буферность почв, устойчивость реакции во времени и по отношению к внешним воздействиям. Фактор интенсивности характеризует силу мгновенного действия кислот или оснований на почву и растения; от него зависит поступление минеральных веществ в растения в данный отрезок времени. Это позволяет дать более правильную оценку кислотности почв, так как в этом случае учитывается общее количество ионов водорода и алюминия, находящихся в почве в свободном и поглощенном состояниях.Актуальную кислотность (рН), определяют потенциометрически. Потенциальную кислотность определяют переведением в р-р ионов водорода и алюминия при обработке почвы избытком нейтральных солей (KCl):
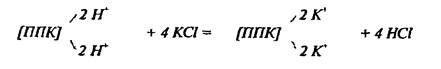
По количеству образовавшейся свободной соляной кислоты судят об обменной кислотности почвы. Часть ионов Н+ остаётся в поглощённом состоянии (образующаяся в результате р-ии сильная HCl полностью диссоциирует и избыток свободных Н+ в растворе препятствует их полному вытеснению из ППК). Менее подвижная часть ионов Н+ может быть переведена в раствор лишь при дальнейшей обработке почвы растворами гидролитически щелочных солей (CH3COONa).
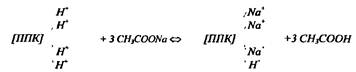
По количеству образовавшейся свободной уксусной кислоты судят о гидролитической кислотности почв. Ионы водорода при этом наиболее полно переходят в раствор (вытесняются из ППК), т.к. образующаяся уксусная кислота прочно связывает водородные ионы и реакция смещается вправо вплоть до полного вытеснения ионов водорода из ППК. Величина гидролитической кислотности равна разности между результатами, полученными при обработке почвы CH3COONa и KCl. На практике за величину гидролитической кислотности принимают результат, полученный при обработке почвы CH3COONa.
Кислотность почвы обуславливается не только ионами водорода, но и алюминия:
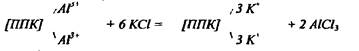
Гидроокись алюминия выпадает в осадок, и система практически ничем не отличается от той, в которой содержатся только поглощённые ионы водорода. Но если даже АlСl% останется в растворе, то при титровании
АlСl3+ 3 NaOH = А(ОН)3 + 3 NaCl
что равноценно реакции
3 НСl + 3 NaOH = 3 NaCl + 3 Н2О.Поглощённые ионы алюминия вытесняются и при обработке почвы раствором CH3COONa. В этом случае весь вытесненный алюминий переходит в осадок в виде гидроокиси.
По степени кислотности, определяемой в солевой вытяжке 0.1н. КKCl потенциометрически, почвы делятся на:
| очень сильно кислые | сильно кислые | средне кислые | слабо кислые | близкие к нейтральным | нейтральные |
| рН менее 4.0 | 4.1-4.5 | 4.6 - 5.0 | 5.1 - 5.5 | 5.6-6.0 | рН более 6.0 |
9)Определение рН, обменной кислотности и подвижного
алюминия по Соколову
Определение обменной кислотности основано на вытеснении из ППК ионов водорода и алюминия 1.0 н. раствором КKCl:
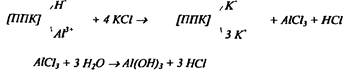
Образовавшуюся кислоту оттитровывают щёлочью и рассчитывают величину обменной кислотности, обусловленную суммой ионов водорода и алюминия. Al осаждают 3.5% р-ром NaF. В осадке образуется комплексная нейтральная соль-криолит:
AlCl3 + 6NaF = Na3AlF6 + 3NaCl
Повторное титрование раствора позволяет определить кислотность, обусловленную только ионами водорода. По разности данных первого и второго титрования проводят расчёт содержания алюминия в почве.
Ход анализа
1. На технических весах взять навеску 40 г воздушно-сухой почвы методом средней пробы.
2. Перенести навеску в коническую колбу ёмкостью 150-300 мл.
3. Прилить из бюретки 100 мл 1.0 н. KCl (рН 5.6-6.0).
4. Взбалтывать на ротаторе 1 час или взбалтывать 15 мин. и оставить на ночь.
5. Отфильтровать через воронку с сухим бумажным складчатым фильтром, отбросив первую порцию фильтрата.
6. В фильтрате определить значение рН потенциометрически.
7. Для определения обменной кислотности взять пипеткой 25 мл фильтрата в колбу Эрленмейера объемом 100 мл.
8. На горелке или электроплитке кипятить фильтрат 5 мин. по песочным часам для удаления углекислого газа.
9. Прибавить в фильтрат 2 капли фенолфталеина и оттитровать горячий раствор 0.01 или 0.02 н. раствором щёлочи (КОН или NaOH) до устойчивой розовой окраски — 1-ое титрование.
10. В другую колбу Эрленмейера взять пипеткой также 25 мл фильтрата прокипятить 5 мин., охладить в водяной бане до комнатной температуры.
11.В охлаждённый фильтрат прилить пипеткой 1.5 мл 3.5 %-го раствора фтористого натрия, перемешать.
12. Прибавить 2 капли фенолфталеина и оттитровать 0.01 или 0.02 н. раствором щёлочи до слабо-розовой окраски 2-ое титрование.
Расчет
1. Обменная кислотность, обусловленная ионами водорода и алюминия (по результатам 1-го титрования) в мг-экв на 100 г сухой почвы:
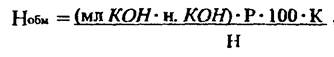
где: Р - разведение 100/25=4; Н - навеска почвы в граммах; К- коэффициент влажности почвы; мл КОН- количество щёлочи, пошедшее на титрование; н. КОН - нормальность щелочи.
2 Расчет кислотности, обусловленной ионами водорода тот же, но по результатам второго титрования, после осаждения алюминия.
3. Расчёт содержания алюминия (ионов) по разности 1-го и 2-го определений (Н+ + Аl3+) мг-экв – Н+ мг-экв =Аl3+ мг-экв/100 г почвы, умножив полученное значение на 9 (эквивалентный вес алюминия), определяем количество алюминия в мг на 100 г почвы.
• При определении этих показателей во влажной почве одновременно
определяют процент влажности.
Реактивы
1. Раствор 1 н. КСl, 74.6 г х.ч. КСl растворить в 400-500 мл дистиллированной воды, перенести в мерную колбу 1 л и довести до метки. рН реактива должен быть 5.6-6.0 (проверить перед началом анализа - в случае необходимости установить нужное значение рН добавлением 10%-го раствора КОН)
2. 0.01 или 0.02 н. раствор КОН или NaOH готовится из навески реактива или фиксанала.
3. 3.5% раствор фтористого натрия, приготовленный на дистиллированной воде без СО2 (кипятить дистиллированную воду, упаривая до 1/3 первоначального объёма).
10) Методы определения приоритетных загрязняющих веществ
в почвах
Отдельно, в виду актуальности и важности задачи, следует упомянуть о необходимости анализа тяжелых металлов в почвах. Выявление загрязнения почв тяжелыми металлами производят прямыми методами отбора почвенных проб на изучаемых территориях и их химического анализа. Также используют ряд косвенных методов: визуальная оценка состояния фитогенезов, анализ распространения и поведения видов – индикаторов среди растений, беспозвоночных и микроорганизмов. Рекомендовано отбирать образцы почв и растительности по радиусу от источника загрязнения с учетом господствующих ветров по маршруту протяженностью 25-30 км. Расстояние от источника загрязнения для выявления ореола загрязнения может изменяться от сотен метров до десятков километров. Выявить уровень токсичности тяжелых металлов непросто. Для почв с разными механическими составами и содержанием органического вещества этот уровень будет неодинаков. Предложены ПДК для ртути 25 мг/кг, мышьяка – 12-15, кадмия – 20 мг/кг. Установлены некоторые губительные концентрации ряда тяжелых металлов в растениях (г/млн.): свинец 10, ртуть – 0,04, хром – 2, кадмий – 3, цинк и марганец – 300, медь – 150, кобальт – 5, молибден и никель – 3, ванадий – 2.
Кадмий. В растворах кислых почв он присутствует в формах Cd2+ , CdCl+ , CdSO4 , щелочных почв - Cd2+ , CdCl+ ,CdSO4 ,CdHCO3 . Ионы кадмия (Cd2+) составляют 80-90% общего количества в растворе за исключением тех почв, которые загрязнены хлоридами и сульфатами. В этом случае 50% общего количества кадмия составляют CdCl+ и CdSO4. Кадмий склонен к активному биоконцентрированию, что приводит в короткое время к его избытку в биодоступных концентрациях. Т.о., кадмий по сравнению с другими тяжелыми металлами является наиболее сильным токсикантом почв. Кадмий не образует собственных минералов, а присутствует в виде примесей, большая его часть в почвах представлена обменными формами (56-84%). Кадмий практически не связывается с гумусовыми веществами.
Свинец. Для почв характерны менее растворимые и менее подвижные формы свинца по сравнению с кадмием. Содержание этого элемента в водорастворимой форме составляет 1,4%, в обменной - 10% от валового; более 8% свинца связано с органическим веществом, большая часть этого количества приходится на фульваты. С минеральной составляющей почвы связано 79% свинца. Концентрации свинца в почвах фоновых районов мира 1-80 мг/кг. Результаты многолетних мировых исследований показали среднее содержание свинца в почвах 16 мг/кг.
Ртуть. Ртуть - самый токсичный элемент в природных экосистемах. Ион Hg2+ может присутствовать в виде индивидуальных ртутьорганических соединений (метил-, фенил-, этилртуть и др.). Ионы Hg2+ и Hg+ могут быть связаны с минералами как часть их кристаллической решетки. При низких значениях pH почвенной суспензии большая часть ртути сорбирована органическим веществом, а по мере увеличения pH возрастает количество ртути, связанной с почвенными минералами.
Свинец и кадмий. Для определения содержания свинца и кадмия в объектах природной среды на фоновом уровне наиболее широко применяется метод атомно-абсорбционной спектрофотометрии (ААС). Метод ААС основан на атомизации переведенного в раствор определяемого элемента в графитовой кювете в атмосфере инертного газа и поглощении резонансной линии спектра испускания лампы полого катода соответствующего металла. Абсорбцию свинца измеряют при длине волны 283,3 нм, кадмия при длине волны 228,8 нм. Анализируемый раствор проходит стадии сушки, озоления и атомизации в графитовой кювете при помощи высокотемпературного нагрева электрическим током в потоке инертного газа. Поглощение резонансной линии спектра испускания лампы с полым катодом соответствующего элемента пропорционально содержанию этого элемента в пробе. При электротермической атомизации в графитовой кювете предел обнаружения свинца 0,25 нг/мл, кадмия 0,02 нг/мл.Твердые образцы почвы переводят в раствор следующим образом: 5 г воздушно-сухой почвы помещают в кварцевую чашку, заливают 50 мл концентрированной азотной кислоты, осторожно упаривают до объема приблизительно 10 мл, добавляют 2 мл 1 н. раствора азотной кислоты. Пробу охлаждают и фильтруют. Фильтрат разбавляют до 50 мл бидистиллированной водой в мерной колбе. Аликвоту пробы 20 мкл микропипеткой вводят в графитовую кювету и измеряют концентрацию элемента.
Ртуть. Наиболее селективным и высокочувствительным методом определения содержания ртути в различных природных объектах является атомно-абсорбционный метод холодного пара. Пробы почвы минерализуют и растворяют смесью серной и азотной кислот. Получаемые растворы анализируют методом атомной абсорбции. Ртуть в растворе восстанавливают до металлической ртути и с помощью аэратора пары ртути подают непосредственно в кювету атомно-абсорбционного спектрофотометра. Предел обнаружения - 4 мкг/кг.Измерения проводят следующим образом: аппаратуру выводят на рабочий режим, включают микропроцессор, растворенную пробу объемом 100 мл переливают в пробу, затем добавляют 5 мл 10%-го раствора хлорида олова и немедленно вставляют аэратор с пробкой на шлифе. Фиксируют максимальное показание спектрофотометра, по которому и проводят расчет концентрации.
Б) Анализ растений
Анализ растений позволяет решить следующие задачи.
1. Исследовать трансформацию макро- и микроэлементов в системе почва- растение - удобрения при различных режимах выращивания растении.
2. Определить содержание основных биокомпонентов в растительных объектах и кормах: белков, жиров, углеводов, витаминов, алкалоидов и соответствие их содержания принятым нормам и стандартам.
3. Оценить меру пригодности растений для потребителя (нитраты, тяжелые металлы, алкалоиды, токсиканты).
1) Отбор растительной пробы
Отбор растительной пробы - ответственный этап работы, требует определённых навыков и опыта. Ошибки при отборе пробы и подготовке к анализу не компенсируются качественной аналитической обработкой собранного материала. Основа в отборе проб растений в агро- и биоценозах метод средней пробы. Чтобы средняя проба отражала статус всей совокупности растений, учитывают макро- и микрорельеф, гидротермические условия, равномерность и густоту стояния растений, их биологические особенности.
Растительные пробы отбираются в сухую погоду, в утренние часы, после высыхания росы. При изучении процессов обмена веществ в растениях в динамике эти часы соблюдаются в течение всего вегетационного периода.
Различают культуры сплошного сева: пшеница, овёс, ячмень, злаковые культуры, травы и др. и пропашные: картофель, кукуруза, свекла и т.п.
Для культур сплошного сева на опытном участке выделяются равномерно 5-6 площадок размером 0.25-1.00 м2, растения с площадки скашиваются на высоте 3-5 см. Общий объём взятого материала составляет объединенную пробу. После тщательного усреднения этой пробы отбирают средний образец массой 1 кг. Проводят взвешивание средней пробы, а затем разбор по ботаническому составу, учёт сорняков, больных растений, которые исключают из состава пробы.
Проводят разделение растений на органы с весовым учётом в пробе листьев, стеблей, початков, цветов, колосьев. Молодые растения не дифференцируют по органам и фиксируют целиком. Для культур пропашных, особенно высокостебельных, таких как кукуруза, подсолнечник и т.д. объединенную пробу составляют из 10-20 растений средней величины, взятых по диагонали делянки или поочерёдно в несмежных рядах.
При отборе корнеплодов выкапывают 10-20 растений средней величины, очищают от почвы, подсушивают, взвешивают, отделяют надземные органы и взвешивают корнеплоды.
Среднюю пробу составляют с учетом размера клубней, початков, корзинок и т.п. Для этого материал сортируют визуально на большие, средние, малые и соответственно долевому участию фракции составляют средний образец. У высокостебельных культур проба может усредняться за счет продольного расчленения всего растения от верхушки до основания.
Критерием оценки правильного отбора пробы является сходимость результатов химического анализа при параллельных определениях. Скорость химических реакций в растительных образцах, взятых в период активной вегетации, намного выше, чем во многих анализируемых объектах. За счёт работы ферментов продолжаются биохимические процессы, в результате которых происходит разложение таких веществ, как крахмал, белки, органические кислоты и особенно витамины. Задачи исследователя - сократить до минимума срок от взятия пробы до проведения анализа или фиксации растительного материала. Снижения скорости реакций можно добиваться работой со свежими растениями на холоде в климатокамере (+4°С), а также кратким хранением в бытовом холодильнике. В свежем растительном материале при естественной влажности проводят определение водорастворимых форм белков, углеводов, ферментов, калия, фосфора, определяют содержание нитратов и нитритов. С небольшой погрешностью эти определения можно выполнять в образцах растений после лиофильной сушки.
В фиксированных воздушно-сухих образцах определяют все макроэлементы, т.е. зольный состав растений, общее содержание белков, углеводов, жиров, клетчатки, пектиновых веществ. Высушивание растительных образцов до абсолютно- сухого веса для проведения анализа недопустимо, так как нарушается растворимость и физико-химические свойства многих органических соединений, происходит необратимая денатурация белков. При анализе технологических свойств любых объектов, допускается сушка при температуре не более 30°С. Повышенные температуры изменяют свойства белково-углеводных комплексов в растениях и искажают результаты определения.
2) Фиксация растительного материала
Сохранение органических и зольных веществ в растительных пробах в количествах, близких к их естественному состоянию, осуществляется за счёт фиксации. Применяется температурная фиксация и лиофильная сушка. В первом случае стабилизация состава растений осуществляется за счёт инактивации ферментов, во-втором - за счёт сублимации, при этом растительные ферменты сохраняются в активном состоянии, белки не денатурируют. Температурная фиксация растительного материала проводится в сушильном шкафу. Растительный материал помещают в пакеты из плотной бумаги типа «крафт» и загружают в сушильный шкаф, предварительно нагретый до 105-110°С. После загрузки выдерживают температуру 90-95°С в течении 10-20 минут в зависимости от свойств растительного материала. При такой температурной обработке за счёт паров воды происходит инактивация растительных ферментов. По окончании фиксации растительный материал должен быть влажным и вялым при этом он должен сохранить свою окраску. Дальнейшее высушивание пробы проводят при доступе воздуха в открытых пакетах при температуре 50-60°С в течение 3-4 ч. Превышать указанные интервалы температуры и времени не следует. Длительное нагревание при высокой температуре приводит к термическому разложению многих азотсодержащих веществ и карамелизации углеводов растительной массы. Растительные образцы с большим содержанием воды- корнеплоды, фрукты, ягоды и т.п. разделяют на сегменты так, чтобы в анализ попали периферийные и центральная части плода. Набор сегментов для пробы составляют из сегментов больших, средних и маленьких плодов или клубней в соответствующем соотношении их в урожае. Сегменты средней пробы измельчают и фиксируют в эмалированных кюветах. Если образцы объёмны, то надземную часть растений непосредственно перед фиксацией измельчают и быстро закрывают в пакеты. Если в образцах предполагается определение только набора химических элементов, их можно не фиксировать, а высушить при комнатной температуре. Высушивание растительного материала лучше провести в термостате при температуре 40-600С так как при комнатной температуре возможно загнивание массы и загрязнения пылевыми частицами из атмосферы. Не подвергают температурной фиксации образцы зерна и семян, но высушивают их при температуре не выше 30°С. Лиофилизация растительного материала (высушивание путём возгонки) основана на испарении льда минуя жидкую фазу. Высушивание материала при лиофилизации проводится следующим образом: отобранный растительный материал замораживают до твёрдого состояния, заливая образец жидким азотом. Затем образец помещают в лиофилизатор, где при низкой температуре и в условиях вакуума происходит высушивание. При этом влага поглощается специальным осушителем (реактивом) в качестве которого используется силикагель, хлористый кальций и т.д. Лиофильная сушка подавляет ферментативные процессы, но сами ферменты сохраняются.
3) Размол растительных образцов и их хранение
Размол растений проводят в воздушно-сухом состоянии. Скорость размола увеличивается, если образцы предварительно подсушиваются в термостате. Отсутствие в них гигроскопической влаги определяется визуально: хрупкие, легко разламывающиеся в руках стебли и листья - наиболее пригодный материал для размола
Для размола объёмных образцов, весом более 30 г, используют лабораторные мельницы, для размола небольших проб используют бытовые кофемолки. При очень малых количествах растительные пробы измельчают в фарфоровой ступке с последующим пропусканием материала через сито. Измельчённый материал просеивается через сито. Диаметр отверстий зависит от специфики анализа: от 1 мм до 0.25 мм. Часть материала, не прошедшая через сито, повторно измельчается на мельнице или в ступке. "Отброс" растительного материала не допускается, так как это изменяет состав средней пробы. При большом объёме размолотых образцов можно снизить объём, перейдя от средней лабораторной пробы к средней аналитической, вес последней составляет 10-50 г, а для зерна не менее 100 г. Отбор производится методом квартования. Лабораторная проба равномерно распределяется на бумаге или стекле в виде круга или квадрата. Шпателем делится на мелкие квадратики (1-3 см) или сегменты. Материал из несмежных квадратиков отбирается в аналитическую пробу.
4) Определение различных веществ в растительном материале
Определение водорастворимых форм углеводов
Содержание углеводов и их разнообразие определяются видом растения, фазой развития и абиотическими факторами среды и изменяются в широких пределах. Существуют количественные методы определения моносахаридов: химические, поляриметрические. Определение полисахаридов в растениях осуществляется теми же методами, но, прежде кислородная связь (-О-) этих соединений разрушается в процессе кислотного гидролиза. Один из основных методов определения - метод Бертрана основан на извлечении растворимых углеводов из растительного материала горячей дистиллированной водой. В одной части фильтрата определяют моносахариды, в другой - после гидролиза соляной кислотой - ди- и трисахариды, которые распадаются при этом до глюкозы
Определение калия, фосфора, азота основывается на реакциях гидролиза и окисления органических веществ растений сильными окислителями (смесь серной и хлорной к-т). Основным окислителем является хлорная кислота (НСlO4). Безазотистые органические вещества окисляются до воды и углекислоты, высвобождая зольные элементы в виде оксидов. Азотсодержащие органические соединения гидролизуются и окисляются до воды и углекислоты, освобождают азот в виде аммиака, который немедленно связывается серной кислотой. Таким образом, в растворе находятся зольные элементы в виде оксидов и азот в форме сернокислого аммония и аммонийной соли хлорной кислоты. Метод исключает потери азота, фосфора и калия в виде их оксидов, так как растительное вещество оголяется при температуре 332°С. Это температура кипения серной кислоты, у хлорной кислоты значительно меньшая температура кипения - 121°С.
Определение содержание нитратов и нитритов. Растения накапливают нитраты и нитриты в больших количествах. Эти соединения токсичны для человека и животных, особенно опасны нитриты, токсичность которых в 10 раз выше, чем нитратов. Нитриты в организме человека и животных переводят двухвалентное железо гемоглобина в трехвалентное. Образующийся при этом метагемоглобин не способен переносить кислород. Необходим строгий контроль за содержанием нитратов и нитритов в растениеводческой продукции. Для определения содержания нитратов в растениях разработан ряд методов. Наибольшее распространение получил ионометрический экспресс-метод. Нитраты извлекают раствором алюмокалиевых квасцов с последующим измерением концентрации нитратов в растворе с помощью ионселективного электрода. Чувствительность метода 6 мг/дм3. Предел определения нитратов в сухом образце - 300 мл-1, в сыром - 24 -30 мл-1. Несколько более подробно остановимся на анализе общего азота в растениях.
5) Определение общего азота по Кьельдалю
Более высокое содержание азота наблюдается в генеративных органах, особенно в зерне, и меньше его концентрация в листьях, стеблях, корнях, корнеплодах, очень мало в соломе. Общий азот в растении представлен двумя формами: азотом белковым и азотом небелковых соединений. К последним относится азот, входящий в состав амидов, свободных аминокислот, нитратов и аммиака.
Содержание белка в растениях определяют по количеству белкового азота Содержание белкового азота (в процентах) умножают на коэффициент 6.25 при анализе вегетативных органов и корнеплодов и на 5.7 при анализе зерна. На долю небелковых форм азота приходится в вегетативных органах 10-30 % от общего азота, а в зерне не более 10%. Содержание небелкового азота к концу вегетации снижается, поэтому в производственных условиях его долей пренебрегают. Определяют в этом случае общий азот (в процентах) и его содержание пересчитывают на белок. Этот показатель называется "сырой белок", или протеин. Принцип метода. Навеску растительного материала озоляют в колбе Кьельдаля концентрированной серной кислотой в присутствии одного из катализаторов (металлического селена, перекиси водорода, хлорной кислоты и т.п.) Температура озоления 332°С. В процессе гидролиза и окисления органической массы азот в колбе сохраняется в растворе в виде сульфата аммония. Для освобождения аммиака используют 40%-ный раствор щёлочи:
(NH4)2SO4+ 2NaOH =Na2S04 + 2 NН4ОН
Отгон аммиака ведут в аппарате Кьельдаля при нагревании и кипении раствора.
В кислой среде нет гидролитической диссоциации сульфата аммония, парциальное давление аммиака равно нулю. В щелочной среде происходит смещение равновесия, и в растворе образуется аммиак, который при нагревании легко улетучивается.
2NH4OH = 2NH3• 2Н20.
Аммиак не теряется, а переходит по холодильнику вначале в виде газа, а затем, конденсируясь, каплями попадает в приёмник с титрованной серной кислотой и связывается ею, вновь образуя сернокислый аммоний:
2NH3+ H2SO4= (NH4)2S04.
Избыток кислоты, не связанный с аммиаком, оттитровывается щёлочью точно установленной нормальности по комбинированному индикатору или по метилроту.
Ход анализа
1. На аналитических весах взять навеску растительного материала ≈0,3-0,5 ± 0 0001 г с помощью пробирки (по разности между весом пробирки с навеской и весом пробирки с остатками материала) и, надев на конец пробирки резиновую трубку длиной 12- 15 см, осторожно опустить навеску на дно колбы Кьельдаля. Прилить в колбу небольшим цилиндром 10-12 мл концентрированной серной кислоты (d=1.84). Равномерное озоление растительного материала начинается уже при комнатной температуре, поэтому залитые кислотой навески лучше оставить на ночь.
2. Поставить колбы на электроплитку и проводить постепенное сжигание вначале на слабом огне (положить асбест), затем на сильном, периодически осторожно взбалтывая. Когда раствор станет однородным, прибавить катализатор (несколько кристаллов селена или несколько капель перекиси водорода) и продолжить сжигание до полного обесцвечивания раствора.
Катализаторы. Повышению температуры кипения серной кислоты и ускорению озоления способствует применение катализаторов. В различных модификациях метода Кьельдаля используют металлические ртуть и селен, сернокислый калий, сернокислую медь, перекись водорода. Использовать для сжигания в качестве катализатора хлорную кислоту отдельно или в смеси с серной кислотой не рекомендуется. Скорость окисления материала обеспечивается в этом случае не за счёт повышения температуры, а за счет быстрого выделения кислорода, что сопровождается потерями азота при озолении.
3. Отгон аммиака. После окончания сжигания колбу Кьельдаля охлаждают и в неё осторожно приливают по стенкам дистиллированную воду, перемешивают содержимое и ополаскивают горлышко колбы. Первую порцию воды наливают до горлышка и количественно переносят в круглодонную колбу емкостью 1 л. Колбу Кьельдаля еще 5-6 раз промывают небольшими порциями горячей дистиллированной воды, сливая каждый раз промывные воды в отгонную колбу. Наполняют отгонную колбу промывными водами до 2/3 объема и добавляют 2-3 капли фенолфталеина. Малое количество воды затрудняет парообразование при отгоне, а большое может вызвать переброс кипящей воды в холодильник.
4. В коническую колбу или химический стакан ёмкостью 300- 400 мл (приёмник) наливают из бюретки 25-30 мл 0.1 н. H2SO4 (с точно установленным титром), добавляют 2-3 капли индикатора метилрота или реактива Гроака (лиловая окраска). Кончик трубки холодильника погружают в кислоту. Отгонную колбу ставят на нагреватель и подсоединяют к холодильнику, проверяя герметичность соединения. Для разрушения сернокислого аммония и отгона аммиака используют 40 %-ный раствор щёлочи, взятый в таком объёме, который в четыре раза превосходит объём концентрированной серной кислоты, взятой при сжигании пробы
5. Отгонную колбу прямо на нагревателе открывают, наклоняют, в левой руке удерживают колбу и пробку холодильника. В колбу по стенке приливают отмеренное количество щёлочи так, чтобы она опустилась вся на дно колбы, и пробку холодильника быстро закрывают. Это вызвано тем, что реакция взаимодействия щелочи и сульфата аммония начинается и без нагревания, что приводит к потерям аммиака. Горлышко колбы нельзя по всей поверхности заливать щёлочью, так как пробка холодильника выскочит при кипячении.
6. Закрытую колбу осторожно и тщательно взбалтывают круговыми движениями, при этом в стакан-приёмник проскакивают первоначально пузырьки воздуха. Раствор в колбе сначала становится красного цвета, а затем темнеет, и при нагревании появляется объёмный осадок. Включают нагреватель и холодильник и приступают к отгону аммиака. Через 20-25 мин после начала отгона опускают стакан-приёмник так, чтобы раствор аммиака из холодильника стекал по стенке стакана. Кипение в отгонной колбе должно быть равномерным и достаточно интенсивным, иначе кислота из стакана будет засасываться в холодильник за счёт перепада внутреннего и наружного давления газов. Если засасывание началось, надо усилить нагрев отгонной колбы и вынуть конец трубки холодильника из раствора кислоты, для этого опустить стакан-приёмник.
7. Отгон считать законченным, когда содержимое отгонной колбы испарится до 1/3 первоначального объёма. Полноту отгона аммиака проверяют универсальным индикатором, лакмусом или реактивом Несслера, для чего берут несколько капель из холодильника на индикаторную бумагу или в пробирку, куда добавлен реактив Несслера. Он дает с аммиаком жёлтое окрашивание. Если в процессе отгона жидкость в приёмнике изменит окраску, необходимо добавить точно фиксированное количество 0.1 н. H2SO4(20 мл), так как первоначального объёма кислоты не хватило для связывания аммиака.
8. По окончании отгона, носик холодильника споласкивают дистиллированной водой из промывалки в приёмник.
9. Содержимое приёмника титруют 0.1 н. раствором едкого калия, перемешивая осторожно стеклянной палочкой, до перехода окраски метилового красного в бесцветную, а по реактиву Гроака от лиловой в светло-зелёную. Здесь интенсивность окраски зависит от количества индикатора.
Количество аммиака находят по разности между количеством кислоты в приёмнике, первоначально прилитой, и количеством кислоты, которая не связалась с аммиаком и оттитрована впоследствии щёлочью.
Расчёт
Содержание общего азота:
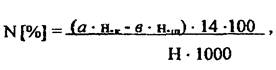
где: a - объём H2SO4 в приёмнике, мл ; н.к- нормальность H2SO4 мг-экв, b - объём щёлочи, израсходованный на титрование, мл; н.щ- нормальность щелочи, мг-экв; 14 - атомная масса азота; Н - навеска, г; 1000 - коэффициент пересчёта мг в г.
Реактивы
1. H2SO4 (d=1.84)
2.40 %-й KOH.
3. Селен металлический порошок.
4. 0.1 н. раствор H2SO4, готовится из фиксанала.
5. 0.1 н. раствор NaOH или КОН, готовится из фиксанала.
6. Индикатор Гроака, комбинированный, при рН 5.5 - чёткое изменение фиолетового цвета на зелёный.
Приготовление:
А - 0.15 г метиленового красного растворяют в 102 мл этилового спирта-ректификата;
Б - 0.05 г метиленового голубого растворяют в 5 мл дистиллированной воды. Смешанный индикатор хранят в склянке из тёмного стекла.
В) Анализ удобрений
1) Определение видов и форм некоторых минеральных удобрений
по качественным реакциям
1. Простые минеральные удобрения могут быть кристаллическими (к ним относятся все азотные, кроме цианамида кальция и все калийные) и аморфными (к ним относятся все фосфорные удобрения и известковые материалы).
2. Растворимость в воде: кристаллические удобрения заметно растворимы либо полностью растворимы. Аморфные удобрения, как правило, слабо растворимы или нерастворимы.
3. Гранулометрический состав: азотные удобрения выпускаются в гранулах и покрыты слабой легкорастворимой гидрофобной плёнкой, за исключением цианамида кальция, сульфата- и хлорида аммония; калийные - в виде крупных кристаллов белого или розового цвета (хлорид калия) или мелкокристаллических порошков с серым оттенком - все остальные. Простые фосфорные удобрения представлены матовыми гранулами серо-белого цвета различных оттенков и аморфными порошками, известковые материалы - аморфные порошки различной тонины помола, сложные и комплексные удобрения - матовыми гранулами беловато-серовато-розового оттенка.
4. В состав кристаллических удобрений входят следующие ионы, которые достаточно легко определяются качественными реакциями: NH4+ K+,. Ca2+, Na+, SO42-, NO3-, Cl-. Для открытия иона NH4+ используют реакцию удобрения со щёлочью, выделение в этой реакции аммиака при нагревании устанавливается по запаху.
NH4N03 + NaOH = NaNO3 + NH3↑ + H2О
Присутствие иона NO3- устанавливается с помощью дифениламина, который при взаимодействии с нитрат-ионом образует в растворе соединения синего цвета. Для открытия сульфат-иона используют реакцию с хлоридом бария:
![]()
Выпадает белый кристаллический осадок. Образовавшийся осадок растворяется под действием соляной и уксусной кислоты. Присутствие K+,. Ca2+, Na+ обнаруживают по окраске пламени: кусочек удобрения помещают на раскалённую деревянную пластинку и вносят в пламя горелки: калийные соли, особенно селитра, вспыхивают и окрашивают пламя в фиолетовый цвет, натриевые соли - в жёлто-оранжевый, кальциевые вспыхивают и сгорают, не окрашивая пламени.
2) Определение в удобрениях содержания аммиачного азота
методом открытого кипячения
Определение основано на том, что при кипячении раствора удобрения, содержащего азот в аммонийной форме, с раствором щелочи образующийся аммиак улетучивается. Его количество эквивалентно количеству щёлочи вступившей в реакцию.
![]()
Избыток щёлочи, не вступившей в реакцию, оттитровывают кислотой соответствующей нормальности. В работе используются растворы кислоты и щёлочи точно установленной нормальности.
Ход анализа
1. Растереть в фарфоровой ступке 30-40 г аммиачного удобрения.
2. Взять на технических весах навеску 10 г (в двукратной повторности), перенести в химический стакан объёмом 150-200 мл, растворить в дистиллированной воде, размешивая стеклянной палочкой.
3. Отфильтровать раствор в мерную колбу ёмкостью 200 мл через воронку диаметром 8-10 см с бумажным обычным фильтром, довести водой до метки, закрыть и взболтать.
4. Взять пипеткой 25 мл фильтрата в колбу коническую объёмом 100 мл, прилить к нему из бюретки 50 мл 0.5 н. раствора щёлочи.
5. Перемешать раствор, закрыть маленькой воронкой (диаметром 2-2.5 см), кипятить на электроплитке или горелке, упаривая раствор до 1/3 первоначального объёма под тягой.
6. Раствор охладить до комнатной температуры, стенки воронки и колбы омыть холодной дистиллированной водой из промывалки.
7. Оттитровать избыток щелочи 0.5 н. раствором H2SO4 из бюретки прибавив 2-3 капли фенолфталеина, до перехода малиновой окраски к бесцветной.
Расчёт
Содержание N
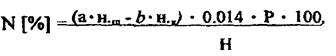
где: а - количество щёлочи, прилитое к раствору удобрения, мл; н.щ.-нормальность щёлочи; b- количество серной кислоты пошедшей на титрование, мл; н.к.- нормальность серной кислоты; Р - разведение 200/25=8; 0 014 - мг-экв азота; Н - навеска удобрения, г;
Реактивы
1. 0.5 н. раствор щелочи (КОН или NaOH) готовят из фиксанала или 28.06 г NaOH растворяют в дистиллированной воде и доводят объём до 1 литра.
2. 0.5 н. раствор серной кислоты готовят из фиксанала или 14 мл конц. H2SO4 прилить к 200-300 мл дистиллированной воды и довести объём до 1 литра.
3. Фенолфталеин. 1 %-ый раствор фенолфталеина в этиловом спирте, ректификате.
Нормальность растворов в данном анализе устанавливается с точностью 0.0001 н.
Заключение
В данной работе мы рассмотрели наиболее важные и актуальные вопросы агрохиманализа, в частности анализ почв, растительных материалов и анализ удобрений. Несколько более подробно рассмотрели самые распространенные методы определения кислотности почв, а так же общего азота в растениях и удобрениях.
Агрохимический анализ необходим для более эффективного ведения сельского хозяйства, сохранения окружающей среды и благоприятной экологической обстановки. Нарушение природного баланса может привести к разрушению гумусного слоя, снижению урожайности сельскохозяйственных культур, нарушению обменной функции почв, появлению заболеваний, опасных, в том числе, и для человека.
Список литературы
1. Воробьева Л.А. Химический анализ почв; МГУ, 1998, с. 273
2. Дурынина Е.П., Егоров В.С. Агрохимический анализ почв, растений, удобрений; МГУ,1998, с. 113
3. Орлов Д.С., Горшкова Е.И. Практикум и семинары по химии почв; МГУ, 1997, с. 42
4. Научные разработки Института Геохимии и Аналитической Химии им. Вернадского В.И., 2006
5. Панников В.Д., Минеев В.Г. Почва, климат, удобрения и урожай; М., Агропромиздат, 1987, с. 248
6. Кожеков Д.С., Воронина Р.А. Негативные последствия применения высоких норм азотных удобрений; М., Агропромиздат, 1986, с. 86
7. Дмитриев М.Т, Малышева А.Г Определение токсикантов в растениях; М., Агрохимия, 1985, с. 286
8. Ефимов В.В. Раскисление почв Черноземья; журнал «Сельские зори» ,1980, № 8
9. Кушниренко Ю.Д. Производство зерна и кормов в агроландшафтном земледелии: агрохимические, экономические и экологические аспекты; Миасс, Геотур, 1999, с. 134
10. Кореньков Д.А. Вопросы агрохимии азота и экология; журнал «Агрохимия», 1990, №11
11. Аринушкина Е.В. руководство по химическому анализу почв; М., Агропромиздат, 1962, с. 315
© 2010 Интернет База Рефератов