
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Курсовая работа: Качественное и количественное определение ионов хрома (III)
Курсовая работа: Качественное и количественное определение ионов хрома (III)
Министерство образования и науки РФ
ГОУ ВПО «КЕМЕРОВСКИЙ ГОСУДАРСТВННЫЙ УНИВЕРСИТЕТ»
химический факультет
кафедра аналитической химии
АНАЛИЗ НЕИЗВЕСТНОГО ВЕЩЕСТВА
(курсовая работа)
Исполнитель:
студентка группы Х-053
Тарасова К. В.
Руководитель:
к.х.н. Ананьев В. А.
Кемерово 2007
Содержание
Введение
Глава 1. Общие вопросы
1.1 Пробоподготовка
1.2 Классификация ионов
1.3 Классификация катионов
1.1.1 Классификация анионов
Глава 2. Качественный анализ
2.1 Обнаружение катионов
2.2 Обнаружение анионов
Глава 3. Количественный анализ
3.1 Методы определения Cr3
3.2 Выбор методики определения
3.3 Экспериментальная часть
3.1.1 Титриметрический метод
3.1.2 Электрохимический метод
Вывод
Список литературы
Введение
Аналитической химией называют науку о методах анализа вещества. Наряду с общей, неорганической, органической, коллоидной и физической химией аналитическая химия является частью химической науки. Предметом аналитической химии как науки является теория и практика химического анализа.
Аналитическая химия решает общие проблемы теории химического анализа, относящиеся к существующим и вновь создаваемым методам.
Аналитическая химия теоретически обосновывает методы качественного и количественного анализа, с помощью которых можно судить о качественном составе вещества и устанавливать количественные соотношения элементов и химических соединений данного вещества.
Задачи аналитической химии можно сформулировать следующим образом:
· Развитие теории химических и физико-химических методов анализа, научное обоснование, разработка и совершенствование приёмов и методов исследования, в том числе автоматических.
· Разработка методов разделения веществ и методы концентрирования микропримесей.
· Совершенствование и разработка методов анализа природных веществ, окружающей среды и технических материалов и т. д.
· Обеспечение химико-аналитического контроля в процессе проведения разнообразных научно-исследовательских работ в области химии и смежных областей науки, промышленности и техники.
· Поддержание химико-технологических и физико-химических процессов производства на заданном оптимальном уровне на основе систематического химико-аналитического контроля всех звеньев промышленного производства.
· Создание методов автоматического контроля технологических процессов, сочетающихся с системами управления на основе использования электронных вычислительных, регистрирующих, сигнализирующих, блокирующих и управляющих машин, приборов и аппаратов.
Аналитическая химия в широком смысле понимания является наукой не только о качественных и количественных методах определения элементного и молекулярного состава вещества, но и наукой о методах химико-аналитического контроля физико-химических и химико-технологических процессов.
Аналитическая химия играет огромную роль в научном и техническом прогрессе, в значительной степени способствуя развитию многих естественных наук, например, геохимии, геологии, минералогии, физики, биологии, агрохимии, а также металлургии, медицины и т. п. Особое значение имеет аналитическая химия в развитии самой химической науки одной из важнейших областей естествознания.
Аналитические определения необходимы для выполнения каждой научно-исследовательской работы по химии. Кроме того, к аналитическим методам исследования прибегают в процессе выполнения научно-исследовательских работ в области геохимии, геологии, минералогии, металлургии, медицины, биологии, агрохимии и др.
Особенно велико значение аналитической химии и химического анализа в производстве, где необходим постоянный контроль для предупреждения брака, причиной которого часто бывают нежелательные примеси в исходном сырье, промежуточных продуктах и готовой продукции.
Аналитическая химия играет решающую роль в деле научного обоснования и разработки современных методов автоматического контроля, без которых невозможно поддержание химико-технологических и физико-химических процессов производства на заданном оптимальном уровне и обеспечение системы автоматического управления производством.
На основании данных химического анализа геологами ведутся поиски полезных ископаемых. На основе многочисленных определений изотопного состава рудных свинцов и метеоритов установлен возраст земной коры (5∙109 лет) и солнечной системы (более 4∙109 – 4,5∙109 лет). По результатам анализа судят о той роли для питания растений и животных, которую играют входящие в состав почв и удобрений так называемые микроэлементы. По данным анализа крови врачи судят о состоянии здоровья человека.
Без современных методов анализа был бы невозможен синтез новых химических соединений. С другой стороны, новые методы производства требуют более современных методов анализа. Роль аналитической химии особенно существенно растёт в настоящее время, когда у нас решается грандиозная задача создания гигантской химической промышленности.
Химический анализ.
Анализ – это метод исследования, основанный на разложении данного вещества на боле простые составные части.
Анализ вещества может проводиться с целью установления качественного и количественного его состава. В соответствии с этим различают качественный и количественный анализ.
Качественный анализ позволяет установить, из каких химических элементов состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе.
Качественный химический анализ большей частью основывается на превращении анализируемого вещества в какое-нибудь новое соединение, обладающее характерными свойствами: цветом, определённым физическим состоянием, кристаллической или аморфной структурой, специфическим запахом и т. п. Химическое превращение, происходящее при этом, называют качественной аналитической реакцией, а вещества, вызывающие это превращение, называют реактивами (реагентами).
При анализе смеси нескольких веществ, близких по химическим свойствам, их предварительно разделяют и только затем проводят характерные реакции на отдельные вещества (или ионы), поэтому качественный анализ охватывает не только отдельные реакции обнаружения ионов, но и методы и разделения.
Количественный анализ позволяет установить количественные соотношения составных частей данного соединения или смеси веществ. В отличие от качественного анализа, количественный анализ даёт возможность определить содержание отдельных компонентов анализируемого вещества или общее содержание определяемого вещества в исследуемом продукте.
Методы качественного и количественного анализа, позволяющие определять в анализируемом веществе содержание отдельных элементов, называют элементарным анализом; индивидуальных химических соединений, характеризующихся определённым молекулярным весом, - молекулярным анализом; функциональных групп – функциональным анализом.
Совокупность разнообразных физических, химических и физико-химических методов разделения и определения отдельных структурных (фазовых) составляющих гетерогенных систем, различающихся по свойствам и физическому строению и ограниченных друг от друга поверхностями раздела, называют фазовым анализом.
Глава 1. Общие вопросы
1.1 Пробоподготовка
Анализируемую смесь солей внимательно осматривают, определяя её внешний вид, цвет, запах, степень измельчения, наличие кристаллических или аморфных фаз. Это позволяет установить, является ли смесь однородной, содержит ли она одну или несколько твёрдых фаз кристаллических или аморфных, каковы размеры частиц.
По окраске анализируемой смеси можно высказать предположения о наличии или отсутствии в ней тех или иных катионов. Если смесь представляет собой бесцветную прозрачную или белую массу, то это указывает на отсутствие в ней значительных количеств окрашенных катионов Cr3+ (сине-фиолетовый или тёмно-зелёный цвет), Mn2+ (светло-розовый), Fe3+ (жёлто-бурый), Со2+ (розовый), Ni2+ (зелёный), Cu2+ (голубой). Если смесь окрашена, то можно предположить содержание в ней одного или нескольких вышеуказанных катионов. При наличии в смеси нескольких различных окрашенных катионов её цвет может быть промежуточным между цветами индивидуальных окрашенных катионов, в зависимости от их относительного содержания и химической формы (соль, комплекс, оксид и т. д.).
Если смесь представляет собой однородное вещество, легко растворимое в воде, то его обычно растворяют в воде, не растирая в порошок. Если же смесь неоднородна и не очень легко растворяется в воде, то её растирают до однородной массы, состоящей из мелких частиц. Мелкие частицы легче перемешиваются и быстрее растворяются в воде.
После проведения тщательного осмотра сухую смесь растирают в порошок в агатовой, яшмовой или фарфоровой ступке.
Действие разбавленной серной кислоты. Разбавленная серная кислота вытесняет слабые кислоты из их солей – карбонатов, сульфитов, тиосульфатов, сульфидов, цианидов, нитритов, ацетатов. Выделяющиеся слабые кислоты, неустойчивые в кислой среде, либо улетучиваются, либо разлагаются с образованием газообразных продуктов. Некоторые из них обладают характерным цветом или запахом.
При наличии в смеси карбонатов выделяется газообразный диоксид углерода СО2 (бесцветный и без запаха). При наличии сульфитов и тиосульфатов выделяется диоксид серы SO2 c запахом горящей серы; при наличии сульфидов – сероводород H2S с запахом тухлых яиц; при наличии цианидов – пары синильной кислоты HCN с запахом горького миндаля; при наличии нитритов – бурые пары диоксида азота NO2; при наличии ацетатов – пары уксусной кислоты СН3СООН с запахом уксуса.
Для проведения теста отбирают немного смеси в пробирку и по каплям прибавляют разбавленную серную кислоту. Выделение газов указывает на присутствие в анализируемой смеси вышеуказанных анионов слабых, неустойчивых в кислой среде кислот.
Действие концентрированной серной кислоты на пробу. Концентрированная серная кислота при взаимодействии с анализируемым веществом может выделять газообразные продукты реакций также из фторидов, хлоридов, бромидов, иодидов, тиоцианатов, оксалатов, нитратов.
При наличии в анализируемом веществе фторидов выделяются пары фтороводорода HF; при наличии хлоридов – пары HCl и газообразный хлор; при наличии бромидов – пары HBr и газообразный жёлтый бром; при наличии иодидов – фиолетовые пары йода I2 , при наличии тиоцианатов – газообразный диоксид серы, при наличии оксалатов – газообразные оксид СО и диоксид СО2 углерода.
Перевод анализируемого вещества в раствор. Предварительные наблюдения и испытания позволяют сделать предположения и выводы о наличии тех или иных катионов и анионов в анализируемой смеси. Дальнейшее подтверждение этих предположений, а также прямые доказательства присутствия катионов и анионов получают при проведении дробного или систематического анализа. Для этого анализируемую смесь сначала переводят в раствор, подбирая подходящий растворитель.
Растворение пробы в воде. Вначале проверяют растворимость в воде при комнатной температуре и (в случае необходимости) при нагревании. Для этого 2—3 мг анализируемого вещества вносят в пробирку, прибавляют ~1,5 мл дистиллированной воды и перемешивают смесь некоторое время. Если вещество при этом полностью растворилось в воде, то большую часть вещества, отобранную для анализа, растворяют в возможно минимальном объеме дистиллированной воды и полученный раствор анализируют далее. Небольшую часть исходной твердой анализируемой пробы оставляют для проведения повторных или проверочных тестов, если это окажется необходимым.
Анализируемое вещество может растворяться в воде неполностью. Для выяснения того, произошло ли частичное растворение пробы в воде, смесь анализируемого вещества (2—3 мг) с водой в пробирке тщательно перемешивают, центрифугируют, отбирают 2—3 капли центрифугата, наносят на часовое или предметное стекло и выпаривают досуха. Если после выпаривания на стекле образовался налет твердого вещества, то это означает, что часть твердой пробы растворилась в воде. В таком случае к большей части исходной пробы прибавляют дистиллированную воду, смесь тщательно перемешивают, центрифугируют и отделяют центрифугат от осадка. Последний промывают 3—4 раза небольшим объемом дистиллированной воды, присоединяя промывные воды к центрифугату. Промывные воды и центрифугат, представляющие собой водную вытяжку растворившейся части пробы, подвергают дальнейшему анализу отдельно от осадка, который далее испытывают на растворимость в кислотах,
Растворение пробы в кислотах. Растворимость в растворах кислот испытывают в том случае, когда анализируемое вещество нерастворимо или частично растворимо в воде. В первом случае проверяют растворимость в кислотах проб (2—3 мг) исходного твердого анализируемого вещества, во втором — проб (2—3 мг) осадка, оставшегося после отделения водной вытяжки.
Отдельно в разных пробирках испытывают растворимость проб в разбавленной уксусной кислоте, разбавленных и концентрированных НСl и НNО3 при необходимости — также в царской водке (при комнатной температуре или при нагревании).
Для проведения теста в пробирки вносят по 2—3 мг анализируемой твердой фазы и прибавляют несколько капель соответствующей кислоты — разбавленной или концентрированной, наблюдая за тем, выделяются или не выделяются газообразные продукты реакций (СО2,SО2, Н2S, NО2). Если вещество не растворяется в кислоте при комнатной температуре, то испытывают его растворимость при нагревании.
При полном растворении пробы в той или иной кислоте для дальнейшего анализа используют полученный раствор.
В случае растворения пробы как в растворе НС1, так и в растворе НN03, для последующего анализа отбирают полученный азотнокислый раствор, так как нитраты менее летучи, чем хлориды, которые частично могут быть потеряны на дальнейших стадиях анализа.
Если проба частично растворяется в уксусной кислоте, то анализируемый образец обрабатывают уксусной кислотой, отделяют центрифугированием нерастворившийся остаток от раствора и уксуснокислый центрифугат подвергают дальнейшему анализу отдельно от осадка. Осадок же испытывают на растворимость в НСl, НNОз, в царской водке, каждый раз отбирая для дальнейшего анализа соответствующий раствор в случае частичного растворения пробы в той или иной кислоте.
Таким образом могут быть получены несколько растворов (водная вытяжка, растворы в разных кислотах), в которых предстоит открыть катионы и анионы. Это в целом облегчает ход анализа, так как уже на этапе растворения происходит частичное разделение некоторых катионов и анионов, которые могут мешать открытию друг друга, если они одновременно присутствуют в одном и том же растворе.
Когда анализируемая смесь содержит сульфаты свинца и катионов третьей аналитической группы, нерастворимые в кислотах, их можно перевести в растворимые в кислотах карбонаты кипячением с насыщенным водным раствором соды Na2СО3 и поташа К2СО3 или же сплавлением со смесью Nа2СО3 и К2СО3.
1.2 Классификация ионов по аналитическим группам
В качественном анализе неорганических веществ исследуются растворы солей, кислот и оснований, которые в водных растворах находятся в диссоциированном состоянии. Поэтому анализ водных растворов электролитов сводится к открытию отдельных ионов, а не элементов или их соединений.
Распределение ионов по аналитическим группам указывает на существование связи между аналитической классификацией ионов и периодической системой элементов Д. И Менделеева. Аналитическая классификация ионов отличается от распределения элементов по группам периодической системы, основанной на общем законе природы. Разделение катионов и анионов по группам основано на отношении ионов к действию реактивов, на сходстве и различии растворимости некоторых образуемых ими соединений и на других признаках.
1.2.1 Классификации катионов
Сероводородная классификация катионов
Аналитическая классификация находится в тесной связи с электронной структурой, а также с энергетической характеристикой ионов – ионными потенциалами, которые определяются как отношение заряда иона z к его радиусу r, т. е. z/r.
Катионы с низкими ионными потенциалами образуют сульфиды, которые не растворимы в сульфиде аммония и едких щелочах. Катионы с высокими ионными потенциалами образуют тиоангидриды соединения, растворимые в сульфиде аммония и едких щелочах.
Кроме ионных потенциалов другими энергетическими характеристиками ионов, определяющих их поведение в растворах, является электростатическая характеристика z2/r (частное от деления квадрата заряда иона на его радиус) и сродство к электрону в водном растворе.
Классификация основана на различии растворимости хлоридов, сульфидов, гидроокисей и карбонатов различных элементов. Применяются следующие групповые реактивы: HCl, H2S, (NH4)2S, (NH4)2CO3, прибавляемых к анализируемой смеси в определённой последовательности.
| Группа | Катионы | Групповой реагент |
| I |
Li+, Na+, K+, NH4+, Mg2+ |
Нет |
| II |
Ca2+, Sr2+, Ba2+ |
Раствор (NH4)2CO3 в аммиачном буфере (рН ≈ 9,2) |
| III |
Al3+, Cr3+ Zn2+, Mn2+, Fe2+, Fe3+, Co2+, Ni2+ |
Раствор (NH4)2S (рН = 7 - 9) |
| IV |
Cu2+, Cd2+, Hg2+, Bi3+ Sn2+, Sn4+, Sb3+, Sb5+, As3+, As5+ |
Раствор H2S при рН = 0,5 |
| V |
Ag+, Hg22+, Pb2+ |
Раствор HCl |
К первой аналитической группе, не имеющей группового реагента, относят катионы лития Li+, , натрия Na+, калия К+, аммония NH4+ и магния Mg2+. Так как эта группа катионов не имеет группового реагента, то катионы открывают в растворе с использованием различных аналитических реакций на каждый катион. Реакции проводят в определенной последовательности.
Ко второй аналитической группе относят катионы кальция Са2+, стронция Sr+ и бария Ва2+, принадлежащие второй группе периодической системы элементов. Групповым реагентом является водный раствор карбоната аммония в аммиачном буфере (рН ≈ 9,2). Групповой реагент осаждает указанные катионы из водного раствора в виде осадков малорастворимых в воде карбонатов СаСОз, SrСОз, ВаСОз.
Катионы кальция, стронция и бария не осаждаются из водных растворов при действии сульфида аммония или сероводорода, так как их сульфиды растворимы в воде.
К третьей аналитической группе относятся катионы алюминия А13+, хрома Сr3+, марганца Мn2+, железа(II) Fе2+, желез(III) Fе3+, кобальта Со2+, никеля Ni2+ и цинка Zn2+.
Групповым реагентом является водный нейтральный или слабо щелочной (рН = 7—9) раствор сульфида аммония (в присутствии аммиака и хлорида аммония), который осаждает из водных растворов катионы алюминия и хрома в виде гидроксидов А1(ОН)з и Сr(ОН)з, а остальные катионы — в виде сульфидов МnS, FeS, Fe2S3 ,СоS, NiS, ZnS. В соответствии с этим катионы третьей аналитической группы, перечисленные в таблице, разделяют на две подгруппы. К первой подгруппе относят катионы алюминия А13+, хрома Сr3+, ко второй подгруппе — катионы марганца Мn2+, железа(II) Fе2+, желез(III) Fе3+, кобальта Со2+, никеля Ni2+ и цинка Zn2+.
Из кислых водных растворов катионы третьей аналитической группы сероводородом не осаждаются.
К четвертой аналитической группе относятся катионы меди Сu2+, кадмия Сd2+, ртути(II) Нg2+, висмута(III) Вi3+, мышьяка Аs3+ и Аs5+, сурьмы Sb3+ и Sb5+ , олова Sn2+ и Sn4+. Групповым реагентом является кислый (0,3 моль/л по НС1) водный раствор сероводорода Н2S при рН = 0,5, который осаждает из водных растворов катионы четвертой аналитической группы в виде малорастворимых в воде сульфидов.
Катионы четвертой аналитической группы разделяют на две подгруппы, исходя из растворимости сульфидов этих катионов в растворе сульфида натрия Nа2S или полисульфида аммония (NН4)2Sn.
К первой подгруппе относят катионы Сu2+, Сd2+, Нg2+, Вi3+. При действии группового реагента они осаждаются в виде сульфидов СиS, CdS, HgS, Вi2S3, нерастворимых в растворах сульфида натрия или полисульфида аммония.
Ко второй подгруппе относят катионы Sn2+, Sn4+, Аs3+, Аs5+, Sb3+, Sb5+. При действии группового реагента они осаждаются в виде сульфидов SnS, SnS2, Аs2Sз, Аs2S5, Sb2S3, Sb2S5, которые растворяются в водных растворах сульфида натрия (за исключением SnS) или полисульфида аммония с образованием тиосолей.
К пятой аналитической группе относят катионы серебра Ag+, ртути (I) Hg22+ и свинца Pb2+. Групповым реагентом является водный раствор соляной кислоты. При действии группового реагента катионы пятой группы осаждаются в виде осадков хлоридов (растворимость хлорида свинца увеличивается при нагревании).
Кислотно-основная классификация катионов
Данная классификация катионов по группам основана на использовании в качестве групповых реагентов водных растворов кислот и оснований — хлороводородной кислоты НС1, серной кислоты Н2SО4, гидроксидов натрия NаОН или калия КОН (в присутствии пероксида водорода Н2О2) и аммиака NН3. Эта классификация менее совершенна, чем сероводородная, и разработана менее детально, однако при ее использовании не требуется получение и применение токсичного сероводорода.
Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп.
| Группа | Катионы | Название группы | Групповой реагент | Характеристика группы |
| I |
Ag+, Hg22+, Pb2+ |
Хлоридная | HCl | Образование малорастворимых хлоридов |
| II |
Ca2+, Sr2+, Ba2+ |
Сульфатная |
Н2SО4 |
Образование малорастворимых в воде сульфатов |
| III |
Al3+, Cr3+ Zn2+, Sn2+, Sn4+, As3+, As5+ |
Амфолитная | NаОН | Образование растворимых солей |
| IV |
Mn2+, Fe2+, Fe3+, Mg2+, Bi3+, Sb3+, Sb5+, |
Гидроксидная | NаОН | Образование малорастворимых гидроксидов |
| V |
Cu2+, Cd2+, Hg2+, Co2+, Ni2+ |
Аммиакатная |
NH4OH |
Образование растворимых комплексов - аммиакатов |
| VI |
Na+, K+, NH4+ |
Растворимая | Нет | Соединения растворимы в воде |
К первой аналитической группе относят катионы серебра, ртути(I) и свинца. Групповым реагентом на катионы первой аналитической группы является водный раствор хлороводородной кислоты (обычно с концентрацией 2 моль/л НС1). Групповой реагент осаждает из водных растворов катионы второй аналитической группы в виде осадков малорастворимых в воде хлоридов серебра АgС1, ртути(I) Нg2С12 и свинца РЬ2С12. Произведения растворимости этих трех хлоридов при комнатной температуре равны соответственно 1,78∙1010, 1,3∙10-18 и 1,6∙10-5. Как видно из этих данных, произведение растворимости хлорида свинца не очень мало, т. е. хлорид свинца заметно растворим в воде, особенно — при нагревании. Растворимость хлорида свинца в воде составляет (г/100 г воды): 0,99 при 25 °С и 2,62 при 80 °С. При действии группового реагента катионы свинца осаждаются из водного раствора неполностью — частично они остаются в растворе.
Ко второй аналитической группе относят катионы кальция, стронция и бария. Групповым реагентом на катионы второй группы является водный раствор серной кислоты (обычно с концентрацией 1 моль/л Н2SО4). При действии группового реагента катионы второй аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция СаSО4, стронция SrSО4 и бария ВаSО4.Произведение растворимости сульфата кальция не слишком мало; при действии группового реагента катионы кальция неполностью осаждаются из водного раствора в форме осадка сульфата кальция — часть ионов Са2+ остается в растворе. Для более полного осаждения катионов кальция в форме сульфата кальция при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость сульфата кальция уменьшается.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах, щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Ва(НSО4)2. Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2SО4 с образованием комплекса (NH4)2[Ca(SO4)2], сульфаты стронция и бария — не растворяются.
Третья аналитическая группа включает катионы алюминия, хрома, цинка, мышьяка и олова. Групповым реагентом является водный раствор гидроксида натрия NaОН (или калия КОН) в присутствии пероксида водорода Н2О2 (обычно — избыток 2 моль/л раствора NаОН в присутствии Н202); иногда — без пероксида водорода. При действии группового реагента катионы третьей аналитической группы осаждаются из водного раствора в виде амфотерных гидроксидов, растворимых в избытке щелочи с образованием гидроксокомплексов.
В присутствии пероксида водорода катионы Cr3+, Аs3+ и Sn2+ окисляются соответственно до хроматинов СrО42-, арсенат-ионов АзО43- и гексагидроксостаннат(IV)-ионов [Sn(ОН)6]2-.
Осадки гидроксидов катионов третьей аналитической группы не растворяются в водном аммиаке, за исключением гидроксида цинка Zn(ОН)2, который растворяется в водном растворе аммиака с образованием аммиачного комплекса [Zn(NН3)4]2+.
К четвёртой аналитической группе относятся катионы магния, марганца, железа, сурьмы, висмута(III). Групповым реагентом является водный раствор щелочи (обычно 2 моль/л раствор NaОН) или 25%-й водный раствор аммиака. При действии группового реагента катионы четвёртой аналитической группы осаждаются из водного раствора в виде гидроксидов. Гидроксиды катионов четвёртой аналитической группы не растворяются в избытке группового реагента, в отличие от катионов третьей аналитической группы.
На воздухе гидроксиды марганца(II) и железа(III) постепенно окисляются кислородом.
При действии группового реагента в присутствии пероксида водорода происходит окисление железа(II) до железа(III), марганца(II) — до марганца(IV), сурьмы(III) — до сурьмы(V).
К пятой аналитической группе относятся катионы меди(II), кадмия, ртути(II), кобальта(II) и никеля(II). Групповым реагентом является 25%-й водный раствор аммиака. При действии группового реагента на водные растворы, содержащие катионы пятой аналитической группы, вначале выделяются осадки различного состава, которые затем растворяются в избытке группового реагента (осадки соединений кобальта и ртути растворяются в избытке водного аммиака только в присутствии катионов аммония NH4+).
Катионы Сu2+, Со2+ и Ni2+ осаждаются из растворов их хлоридов в виде основных хлоридов СuОНСl, СоОНСl NiOНСl, катионы кадмия — в форме гидроксида Сd(ОН)2. Осадки основных солей меди(II), никеля(II) и гидроксида кадмия растворяются в избытке группового реагента с образованием соответствующих аммиачных комплексов.
Осадки, выпавшие из растворов солей кобальта(II) и ртути(II) при действии группового реагента, растворяются в избытке аммиака в присутствии солей аммония с образованием аммиачных комплексов. Аммиачный комплекс кобальта(II) грязно-жёлтого цвета на воздухе окисляется до аммиачного комплекса кобальта(III) вишнёво-красного цвета.
К шестой аналитической группе относят катионы натрия, калия и аммония. Групповой реагент отсутствует.
1.2.2 Классификация анионов
Аналитические классификации анионов основаны на их окислительно-восстановительных свойствах, способности образовывать с катионами малорастворимые соединения, а также на реакциях взаимодействия некоторых с кислотами, сопровождающихся выделением газообразных продуктов. В отличие от катионов, единой общепринятой классификации анионов, учитывающей все эти свойства, не существует.
Классификация анионов, основанная на реакциях осаждения
| Группа | Анионы | Групповой признак | Групповой реагент |
| I |
SO42-, SO32-, S2O32-, CO32-, C2O42-, PO43-, SiO32-, Cr2O72-, CrO42-, F-, B2O72-, AsO33-, AsO43- |
Соли бария и серебра не растворимы в воде, но растворимы в HCl и HNO3 (за исключением BaSO4) |
BaCl2 в нейтральной или слабощелочной среде |
| II |
S2-, Cl-, Br-, I-, SCN-, CN-, IO3-, BrO3- |
Соли бария растворимы, а соли серебра не растворяются в воде и разбавленной HNO3 (кроме BrO3-) |
AgNO3 в азотнокислой среде |
| III |
NO3-, NO2-, CH3COO-, MnO4- |
Соли бария и серебра растворимы в воде | Отсутствует |
Классификация анионов, основанная на их окислительно-восстановительных свойствах
| Группа | Анионы | Групповой признак | Групповой реагент |
| I |
NO2-, Cr2O72-, AsO43-, BrO3- |
Окислители: выделение свободного йода |
KI + H2SO4 |
|
NO3-, Cr2O72-, NO2-, MnO4- |
Окислители: выделение MnCl62- бурого цвета |
MnCl2 + HCl(к) |
|
| II |
SO32-, S2-, S2O32-, NO2-, C2O42-, Cl-, Br-, I-, SCN-, CN-, AsO33- |
Восстановители: обесцвечивание раствора перманганата калия с образованием Mn2+ |
KMnO4 + H2SO4 |
|
SO32-, S2-, S2O32-, AsO33- |
Восстановители: восстановление I2 до I2-, исчезновение синей окраски иодкрахмального комплекса |
I2 в KI, подкислён. H2SO4 |
|
| III |
SO42-, CO32-, PO43-, SiO32-, B2O72-, CH3COO- |
Индифферентные | Отсутствует |
Глава 2. Качественный анализ
2.1 Обнаружение катионов
Анализ смеси, состоящей из трёх неизвестных катионов, начали с проведения предварительных испытаний.
Изучили внешний вид исследуемой смеси. Она состояла из тёмно-зелёных, бесцветных и белых кристаллов. Тёмно-зелёные кристаллы указывают на возможное присутствие катионов хрома. Отсутствие розовых, синих и буро-жёлтых кристаллов говорит об отсутствии соответственно ионов Co2+, Cu2+ и Fe3+.
Измельчили смесь в фарфоровой ступке. Приготовили водную вытяжку: для этого часть исследуемой смеси растворили в воде при нагревании и тщательном перемешивании. При этом небольшое количество вещества осталось в осадке, что свидетельствует о наличии малорастворимого соединения. Также отсутствие в водной вытяжке студенистого осадка указывает на отсутствие в смеси легко гидролизующихся солей Sb3+ и Bi3+.
Провели дробный анализ. Проверили наличие ионов Cr3+: для этого к исследуемому раствору добавили 2М раствор NaOH и 3% Н2О2 и нагрели. Изменение зелёной окраски раствора (цвет аквакомплексов [Cr(H2O)6]3+) на жёлтую (цвет хромат-ионов CrO42-) говорит о присутствии в исследуемой смеси ионов Cr3+.
2[Cr(H2O)6]3+ + 3Н2О2 = 2CrO42- + 6SO42- + 14H+
Проверили наличие ионов Fe2+: к исследуемому раствору прилили раствор красной кровяной соли K3[Fe(CN)6]. Синий осадок не выпал, значит, отсутствуют ионы Fe2+.
Проверили наличие ионов Ni2+ : к анализируемому раствору прилили NH4OH (без избытка), амиловый спирт и диметилглиоксим (реактив Чугаева). Отсутствие малиновой окраски в слое органического растворителя говорит об отсутствии ионов Ni2+.
Проверили содержание в исследуемом растворе ионов аммония NH4+: к раствору прилили избыток щёлочи для растворения выпавших гидроокисей тяжёлых металлов и добавили избыток реактива Несслера (смесь раствора тетраиодомеркурата(II) калия K2[HgI4] с 2н КОН). Образовался красно-бурый осадок иодида меркураммония:
NH4+ + 2[HgI4]2- + 2ОН- = [OHg2NH2]I↓ + 7I- + 3H2O
Cостав осадка описывается формулой:
Провели систематический анализ. К исследуемому раствору добавили этиловый спирт и 2н HCl. Отсутствие осадка свидетельствует об отсутствии катионов I аналитической группы.
К анализируемой водной вытяжке прилили этиловый спирт и 2н H2SO4. осадок не выпал, значит, отсутствуют катионы II аналитической группы.
К исследуемому раствору добавили перекись водорода и 6н NaOH до полного осаждения, затем избыток щёлочи и нагрели при тщательном перемешивании стеклянной палочкой. Прокипятили на водяной бане для удаления избытка перекиси водорода. При этом катионы III аналитической группы остались в растворе, а катионы IV – V группы должны были выпасть в осадок, но этого не произошло, значит, в исследуемом растворе нет катионов IV – V группы.
Находящиеся в полученном растворе ионы CrO42- мешают открытию остальных катионов III аналитической группы, потому для открытия ионов Al3+ провели удаление этих ионов: к раствору добавили сухую соль NH4Cl и прокипятили до полного удаления аммиака (проба со влажной лакмусовой бумажкой). При этом в осадок выпали гидроксиды возможно содержащихся в растворе Al3+ и Sn2+, а в растворе остались ионы CrO42- и, возможно, ионы ZnO22-. Осадок отделили центрифугированием, промыли дистиллированной водой, растворили в 2н HCl и проверили наличие в этом растворе ионов Al3+ : к раствору прилили 2н NH4OH до рН = 10-11 и ализарин (1,2 – диоксиантрахинон). Выпал красный осадок «алюминиевого лака», значит, в исследуемом растворе содержались ионы Al3+.
Al(OH)3 + → + H2O
Дальнейший систематический анализ катионов не имеет смысла, так как открыты все находящиеся в анализируемом растворе катионы.
2.2 Обнаружение анионов
Анализ раствора, содержащего три неизвестных аниона, начали с предварительных испытаний.
Испытали раствор на присутствие анионов слабых кислот: прибавили 2н раствор H2SO4 и нагрели. Отсутствие помутнения раствора и выделения газов, а также запаха свидетельствует об отсутствии сульфитов, карбонатов, тиосульфатов, нитритов, силикатов и ацетатов.
Испытали раствор на присутствие анионов I аналитической группы: прибавили BaCl2 в щелочной среде. Выпал белый осадок, значит, есть катионы I аналитической группы.
Испытали раствор на присутствие анионов II аналитической группы: к раствору прибавили 2М HNO3 и AgNO3, отсутствие осадка говорит об отсутствии анионов II аналитической группы.
Провели дробный анализ. Для открытия SO42- к раствору прилили BaCl2 и исследовали растворимость образовавшегося белого осадка в разбавленных кислотах. Осадок не растворим в кислотах, значит, это BaSO4 и в исследуемом растворе содержались сульфат-ионы.
Ba2+ + SO42- = BaSO4↓
Открыли ионы PO43-: при добавлении к раствору молибдата аммония (NH4)2MoO4 в азотнокислой среде при нагревании образовался жёлтый кристаллический осадок комплексной аммонийной соли фосфоромолибденовой гетерополикислоты фосфоромолибдат аммония:
PO43- + 3NH4+ + 12MoO42- + 24H+ = (NH4)3[PO4(MoO3)12] + 12H2O
Добавили к анализируемому раствору раствор дифениламина в сернокислой среде. Раствор окрасился в синий цвет, значит, в нём могут содержаться нитрат- и/или нитрит-ионы. Так как было доказано отсутствие нитрит-ионов в предварительных испытаниях, то в исследуемом растворе содержались только нитрат-ионы.
Нитрат-ион при реакции с дифениламином в сернокислой среде переводит этот органический реагент в продукт его окисления – синий дифенилдифенохинондиимин («дифенилбензидиновый фиолетовый»). Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
2C6H5NHC6H5 → C6H5 – NH – C6H4 – C6H4 – NH – C6H5 + 2H+ + 2e-
Затем происходит обратимое окисление молекулы бензидина присутствующем окислителем до окрашенного в синий цвет дифенилдифенохинондиимина:
C6H5 – NH – C6H4 – C6H4 – NH – C6H5 ↔ C6H5 – N = = = N - C6H5 ++ 2H+ + 2e-
В результате раствор окрашивается в синий цвет. Образовавшийся синий продукт окисления дифениламина далее необратимо разрушается вначале до продуктов реакции бурого, а затем жёлтого. В соответствии с этим при стоянии синей смеси её окраска постепенно изменяется сначала на бурую, а затем на жёлтую.
Глава 3. Количественный анализ
3.1 Методы определения Cr3+
Хром (III) титруют одним из методов, описанных далее. Анализируемая проба содержит хром (III), и его надо сначала окислить до хрома (VI),что можно сделать следующими способами.
Окисление хрома (III) до хрома (VI).
Окисление висмутатом. Окисление можно провести висмутатом натрия и избыток висмутата отфильтровать.
Ход окисления. К анализируемому раствору, содержащему свободную серную кислоту в 5 н концентрации, прибавляют несколько граммов висмутата натрия, кипятят некоторое время, охлаждают раствор и фильтруют через стеклянный фильтрующий тигель №4. Перед фильтрованием прибавляют немного асбеста, чтобы очень мелкие частички висмутата не прошли сквозь пористое стекло.
Окисление персульфатом в кислой среде. Персульфат в присутствии кислоты (лучше всего в 2,3-2,4 н концентрации) и ионов серебра окисляет при нагревании хром (III) до хрома (VI). Избыток окислителя надо затем разрушить. Хлориды в большом количестве мешают, осаждая ионы серебра.
Ход окисления. К 50 мл анализируемого раствора прибавляют 15 мл 0,1 М раствора нитрата серебра и 50 мл 10% раствора персульфата аммония, после чего кипятят 15 минут.
Окисление окисью серебра AgO. Окись серебра окисляет хром (III) до хрома (VI) на холоду в среде азотной, хлорной или серной кислоты. Избыток окислителя можно разрушить кипячением в течение нескольких минут.
Окисление хлорной кислотой. Хлорная кислота при температуре кипения её азеотропной смеси с водой (200˚С) окисляет хром (III) до хрома (VI). Ход окисления. К 25 мл анализируемого раствора прибавляют 10 мл концентрированной хлорной кислоты и 1 мл концентрированной фосфорной кислоты. Смесь осторожно нагревают в колбе с длинным горлышком. По удалении воды хлорная кислота начинает кипеть. Нагревание регулируют так, чтобы пары хлорной кислоты конденсировались в колбе. После окрашивания раствора в оранжевый цвет (образование хромовой кислоты) продолжают слабое кипячение только 3 мин и охлаждают, возможно, быстрее. Затем жидкость в колбе разбавляют водой и кипятят несколько минут для удаления хлора. При разбавлении водой хлорная кислота перестаёт быть окислителем.
Окисление хрома происходит на 99,5%, но результат определения может получиться более низким из-за потери хрома в виде CrO2Cl2. Если раствор с самого начала содержал ионы Cl-, то надо отогнать HCl в начале выпаривания, нагревая раствор очень осторожно.
Окисление перманганатом. Продолжительное кипячение с перманганатом в кислой среде приводит к окислению хрома (III) до хрома (VI). Избыток перманганата можно удалить с помощью азида натрия в умеренно кислой среде.
Титрование хрома(VI).
Титрование солью железа (II).
Реактивы:
· Соль Мора, 0,1 н раствор в 1 н серной кислоте
· Дифениламинсульфонат, 0,5% раствор
· Фосфорная кислота, концентрированная
Ход определения. К анализируемому раствору бихромата, содержащему свободную серную, хлорную или соляную кислоту, приливают воду до объёма 200 мл, затем 10 мл 6 н серной кислоты, 5 мл концентрированной фосфорной кислоты и 6-8 капель раствора индикатора. Затем титруют раствором соли Мора до тех пор, пока фиолетовая окраска, появляющаяся к концу титрования, не исчезнет сразу.
Титрование тиосульфатом натрия
Реактивы:
· Тиосульфат натрия, 0,05 М
· Иодид калия, 20% раствор
· Крахмал
Ход определения. К раствору бихромата приливают KI , выделившийся йод титруют тиосульфатом с индикатором крахмалом до обесцвечивания раствора.
3.2 Выбор методики
Для анализа была выбрана методика окисления хрома (III) до хрома (VI) персульфатом и титрование полученного бихромата тиосульфатом натрия как наиболее точный и требующий меньших временных затрат.
Экспериментальная часть
3.2.1 Титриметрический метод
Реактивы:
· Na2S2O3, 0,05 М раствор
· AgNO3, 0,01 М раствор
· крахмал
· KI, 20%-й раствор
· H2SO4, 1М
· персульфат аммония
Навеску пробы растворили в 100 мл дистиллированной воды. Отобрали по 10 мл полученного раствора в три термоустойчивые колбы для титрования. В каждую добавили по 10 мл серной кислоты, 5 мл раствора AgNO3 и 1г персульфата аммония, взвешенного на технических весах. Перемешали и нагрели на плитке до кипения. Кипятили 20 мин до появления ярко-жёлтой окраски раствора. Затем остудили, добавили по 5 мл раствора KI. Выделившийся йод оттитровали тиосульфатом натрия с индикатором крахмалом, 5 капель которого добавили в конце титрования. Титровали до исчезновения синей окраски и превращения цвета раствора в молочно-зелёный.
Расчётная формула
![]()
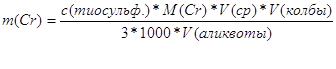
![]()
Обработка результатов
Провели три титрования:
V1 = 11,9 мл
V2 = 11,8 мл Vср = 11,9 мл
V3 = 12,0 мл
![]()
mтеор(Cr) = 0,1027 мг
Ошибка: ε = ![]() *100% = 0,38%
*100% = 0,38%
3.2.2 Электрохимический метод
Потенциометрическое титрование избытка раствора ЭДТА
Реактивы:
· ЭДТА, 0,025 М раствор
· раствор CuSO4
· ацетатный буферный раствор
· NH4SCN, 10%-й раствор
1. Навеску пробы растворили в 100 мл дистиллированной воды.
2. Приготовили рабочий раствор CuSO4. По титру рассчитали концентрацию раствора CuSO4
c(CuSO4)=![]() =
=![]() =0,139 моль/л
=0,139 моль/л
Чтобы приготовить 0,028 М раствор CuSO4 отобрали 20 мл стандартного раствора CuSO4 и разбавили дистиллированной водой в колбе на 100 мл.
c(CuSO4)=![]() =0,0278 моль/л
=0,0278 моль/л
3. В методике предлагается, что в отобранной аликвоте задачи содержалось 5-10 мг Cr3+. Рассчитали, какой объём аликвоты надо отобрать, чтобы в ней содержалось указанное количество Сr3+. Зная теоретическое значение массы полученной задачи, рассчитали концентрацию хрома в растворе:
c(Cr3+)=![]() =1,027 мг/мл
=1,027 мг/мл
4. Отобрали 20 мл раствора Cr(III) и разбавили дистиллированной водой в колбе на 50 мл. Концентрация Cr(III) в данном объёме составляет
c*(Cr3+)=V(Cr3+)*
c(Cr3+)=![]() =0,5252 мг/мл
=0,5252 мг/мл
Исходя из полученной концентрации отобрали аликвоту 10 мл полученного раствора (в 10 мл содержится 5,252 мг хрома, что попадает в интервал 5-10 мг).
5. Добавили 20 мл 0,025 раствора ЭДТА, прокипятили до появления фиолетовой окраски. Затем охладили и добавили 5 мл ацетатного буфера и 0,5 мл 10% раствора роданида аммония.
6. Смесь поместили в стакан для титрования, разбавили дистиллированной водой, погрузили в раствор индикаторный платиновый электрод и хлорсеребряный электрод сравнения. Бюретку заполнили приготовленным 0,028 М раствором CuSO4, включили магнитную мешалку. Провели одно ориентировочное и два точных титрования, добавляя титрант по 0,1 мл и измеряя ЭДС после каждой порции титранта. Результаты измерений приведены в таблице.
| Vтитр, мл | ∆V | Е,mV |
∆Е |
∆Е/∆V |
| 0 | 423 | |||
| 0,5 | 0,5 | 430 | 7 | 14 |
| 1,0 | 0,5 | 435 | 5 | 10 |
| 1,5 | 0,5 | 440 | 5 | 10 |
| 2,0 | 0,5 | 448 | 8 | 16 |
| 2,5 | 0,5 | 450 | 2 | 4 |
| 3,0 | 0,5 | 455 | 5 | 10 |
| 3,1 | 0,1 | 457 | 2 | 4 |
| 3,2 | 0,1 | 457 | 0 | 0 |
| 3,3 | 0,1 | 457 | 0 | 0 |
| 3,4 | 0,1 | 457 | 0 | 0 |
| 3,5 | 0,1 | 457 | 0 | 0 |
| 3,6 | 0,1 | 457 | 0 | 0 |
| 3,7 | 0,1 | 460 | 3 | 30 |
| 3,8 | 0,1 | 461 | 1 | 10 |
| 3,9 | 0,1 | 462 | 1 | 10 |
| 4,0 | 0,1 | 468 | 6 | 60 |
| 4,1 | 0,1 | 469 | 1 | 10 |
| 4,2 | 0,1 | 469 | 0 | 0 |
| 4,3 | 0,1 | 469 | 0 | 0 |
| 4,4 | 0,1 | 470 | 1 | 10 |
| 4,5 | 0,1 | 470 | 0 | 0 |
Построили кривую титрования.
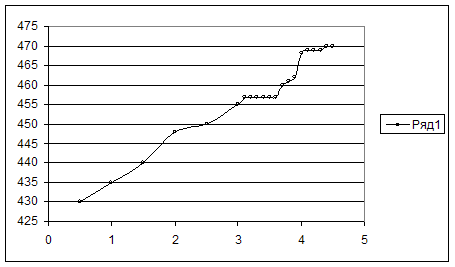
Построили дифференциальную кривую титрования и определили V в точке эквивалентности.
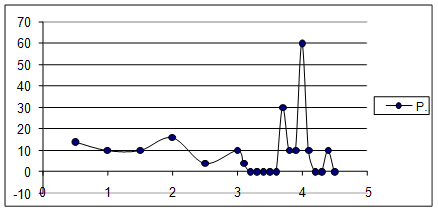
Объём титранта в ТЭ – 3,9 мл
Расчётная формула
m(Cr3+)=![]()
m(Cr3+)=![]() =0,1016 мг
=0,1016 мг
mтеор= 0,1027 мг
Ошибка: ε = ![]() *100% = 1,1%
*100% = 1,1%
Вывод
В ходе данной работы был проведён качественный анализ смеси неизвестного состава и количественный анализ одного из компонентов по двум методикам.
Ошибки определения по титриметрическому и электрохимическому методу составили соответственно 0,38% и 1,1%.
Возможные причины ошибок:
· погрешности приборов;
· потери вещества при отборе аликвот;
· в электрохимическом методе при многократном разбавлении раствора;
· при приготовлении рабочих растворов из стандартных;
В случае присутствия в растворе кроме Cr3+ других обнаруженных ранее ионов, мешающее влияние оказал бы ион Cl-,дающий осадок AgCl при добавлении AgNO3 в качестве катализатора; и ион Al3+, образующий комплекс с ЭДТА.
Список литературы
1. Шарло Г. Методы аналитической химии. Количественный анализ неорганических соединений. Часть вторая.- М.: Химия, 1969.
2. Крешков А.П. Основы аналитической химии. Книга 2.- М.: Химия, 1965.
3. Алексеев В. Н. Количественный анализ. Под ред. д-ра хим. наук П. К. Агасяна. – М.: Химия, 1972.
4. Харитонов Ю.Я. Аналитическая химия (аналитика). Книга 2.- М.: Высшая школа, 2003.
5. Харитонов Ю.Я. Аналитическая химия (аналитика). Книга 1.- М.: Высшая школа, 2003.
© 2010 Интернет База Рефератов