Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Курсовая работа: О-хлорстирол
Курсовая работа: О-хлорстирол
О-хлорстирол
Введение. 2
1. Свойства о-хлорстирола. 3
2. Стадии синтеза о-хлорстирола: 6
3. Установки для проведения синтеза о-хлорстирола и его промежуточных продуктов. 11
4. Очистка и идентификация полученного вещества. 17
5. Техника безопасности при получении и хранении о-хлорстирола. 19
Выводы. 22
Список использованной литературы. 23
В настоящее время существующие в различных химических производствах, антикоррозионной технике, машиностроении, авиастроении и других отраслях промышленности прокладочно-уплотнительные, конструкционные и защитные коррозионно-, озоно-, и термостойкие резины, пластмассы, парониты, эбониты, асборезины, пентапласты и т.п. материалы уже не отвечают возросшим требованиям промышленности.
Эти материалы обладают низкой коррозионной и термической стойкостью, быстро набухают и разрушаются а агрессивных средах, загрязняют эти среды, меняют их цвет и рассчитаны на длительную эксплуатацию не выше 70 – 90°С, в то время как многие современные химические процессы уже проводятся при 100 – 200°С и выше.
Поэтому одним из заданий химической промышленности и науки было создание новых коррозионностойких материалов. Эти материалы получают сополимеризацией этилена или пропилена с бромированными и хлорированными производными бензола. Поэтому и вызывает интерес методика получения о-хлорстирола, который может быть использован к качестве сополимера для производства таких коррозионностойких материалов. О-хлорстирол также находит применение как растворитель органических веществ, красок и лаков.
Главной задачей данной работы будет рассмотреть процесс получения о-хлорстирола из наиболее легкодоступного на данный момент сырья - природного газа (метана). В работе мы рассмотрим последовательность химического синтеза данного вещества, условия его получения.
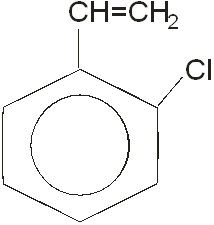
О-хлорстирол является производным ароматических веществ. В соей молекуле он содержит бензольное кольцо. К бензольному кольцу присоединен атом хлора в ортоположение.
О-хлорсирол также называют: 2-хлорстирол, 2- хлорвинилбензол.
Химическая формула вещества: C8H7Cl
Молекулярная масса: 138.6
Структурная формула вещества приведена ниже:
По физическим свойствам о-хлорстирол – это желтая жидкость, довольно вязкая, с резким неприятным запахом. При сгорании образует токсичные газы , включая хлористый водород, фосген. Вещество при определенных условиях образует перекиси, приводящие к началу взрывной полимеризации. Вещество может полимеризоваться.
Рассмотрим физические свойства о-хлорстирола.
Таб.1. физические свойства о-хлорстирола.
| Свойства | Величина |
| Температура кипения | 188.7°C |
| Температура плавления | -63.2°C |
| Относительная плотность (вода = 1) | 1.1 |
| Растворимость в воде | очень плохая |
| Давление паров, кПа при 25°C | 0.13 |
| Относительная плотность пара (воздух = 1) | 4.8 |
| Относительная плотность смеси пар/воздух при 20°C (воздух = 1) | 1.01 |
| Температура вспышки | 58°C |
Мы рассмотрели основные физические свойства о-хлорстирола. Коснемся также его основных химических свойств. Его химические свойства обусловлены наличием в молекуле о-хлорстирола ароматического ядра и ненасыщенной группы. Как представитель ароматических соединений о-хлорстирол будет вступать во все реакции присущие ароматическим соединениям. Он будет реагировать с водородом, галогенами, галогеноводородами с получением циклических насыщенных соединений.
С водородом о-хлорстирол реагирует, вступая в еракцию присоединения водорода:
![]()
Но в молекуле о-хлорстирола есть также ненасыщенная группа, которая является высокореакционной и может вступать в реакции окисления до галогенокислот, вступать в реакции присоединения водорода, галогенов и галогеноводородов, но такая реакция будет конкурировать с реакцией присоединения водорода бензольным ядром. Реакция окисления легко проходит при действии окислителей:
![]()
![]()
Также возможна полимеризация о-хлорстирола:
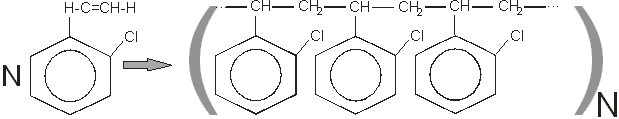
В результате реакции мы получим полихлорстирол. Как полимер он не имеет большого значения и используется только как сополимер для получения бутадиенхлорстирольных и других каучуков.
Стадии синтеза о-хлорстирола:
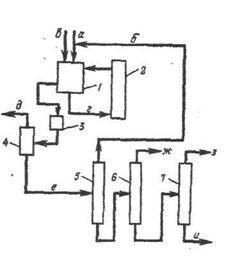
Синтез о-хлорстирола состоит из нескольких последовательных стадий, в процессе синтеза мы получим ацетилен, бензол, стирол и другие органические вещества. Сам процесс синтеза схематически изображен на рисунке (рис. 1).
 рис. 1.
рис. 1.
Как видно из рисунка 1 синтез о-хлорстирола включат в себя такие последовательные синтезы:
а. Синтез ацетилена из метана;
б. Синтез бензола из ацетилена;
в. Синтез этилбензола из бензола и этилена;
г. Синтез стирола из этилбензола;
д. Синтез о-хлорстирола.
Этапы г) и д) могут быть различными для разных видов производств, их можно менять в зависимости от условий.
В дальнейшем мы рассмотрим последовательно каждый из указанных процессов, условия его проведения, используемые катализаторы, температуры реакции.
а) синтез ацетилена из метана, его условия;
Наиболее распространенным видом углеводородного сырья есть природный газ, который на 95 – 98 % состоит из метана. Современная органическая химия должна выходить из того, что в будущем именно природный газ (метан) станет основным сырьем для органического синтеза.
Уже сейчас широко применяются методы получения ацетилена из природного газа – метана. Для этого применяют электрокрекинг, который проходит по уравнению:
![]()
Струю метана пропускают между электродами при температуре 1600° С и быстро охлаждают, чтобы предотвратить разложение ацетилена. Также разработан термоокислительный крекинг (неполное окисление метана кислородом воздуха)
![]()
В реакции используют теплоту частичного сгорания ацетилена. Но в данной реакции мы получаем больше продуктов и выделение ацетилена из них более сложно, чем в случае электрокрекинга.
б) синтез бензола;
ацетилен при температуре красного каления вступает в реакцию тримеризации и в результате мы получим бензол. Эту реакцию открил еще в ХІХ веке М. Бертло.
Н. Д. Зелинский и Б. А. Казанский показали, что Даная реакция значительно лучше проходит при более низких температурах и каталитическом воздействии активированного угля:

Даная реакция получения бензола еще не имеет большого распространения из-за существования более дешевых методов получения его, например из отходов коксирования угля и нефтепеработки.
в) синтез этилена из ацетилена;
Для получения стирола необходим этилен, который можно довольно легко получить, выходя из ацетилена и водорода. Ацетилен как ненасыщенный углеводород легко вступает в реакцию присоединения водорода. Реакция каталитическая, катализатором может быть платина или свинец. При использовании платины и большом количестве водорода в смеси, возможно, получение не только этилена, но и этана, тогда как при применении свинцового катализатора реакция будет продолжаться только до получения этилена.
![]()
Реакция проводится при температуре около 300°С.
г) синтез стирола из бензола и этилена;
Рассмотрим процесс синтеза этилбензола из бензола. Продуктами этого синтеза будут бензол и этилен, получение которых мы рассмотрели выше. Реакция проходит за уравнением:
![]()
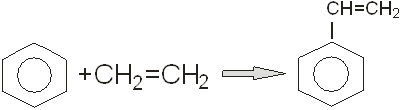
Синтез этилбензола
алкилированием бензола этиленом осуществляют, применяя катализаторы на основе
хлорида алюминия, фторида бора, фосфорной кислоты или цеолитов. Использование
низких концентраций катализатора позволяет проводить процесс в жидкой фазе
(катализатор суспензирован или растворен). Процесс проводят при ![]() и
давлении 0,3-1,0 МПа. В оптимальных условиях проведения процесса селективность
получения этилбензола 99%. При проведении процесса очень важно не допускать
избытка этилена в реакторе, так как это приводит к образованию диэтил- и
полиэтилбензолов. Расход АІСІ3 составляет 0,25 г на тонну этилбензола. Алкилирование
бензола олефинами – типичная реакция электрофильного замещения.
и
давлении 0,3-1,0 МПа. В оптимальных условиях проведения процесса селективность
получения этилбензола 99%. При проведении процесса очень важно не допускать
избытка этилена в реакторе, так как это приводит к образованию диэтил- и
полиэтилбензолов. Расход АІСІ3 составляет 0,25 г на тонну этилбензола. Алкилирование
бензола олефинами – типичная реакция электрофильного замещения.
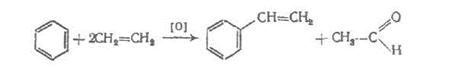
В современной химической технологии используют также процесс производства стирола выходя из пропилена и этилбензола:
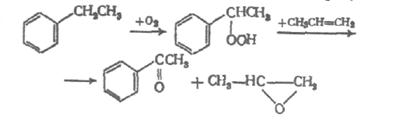
В результате этой реакции кроме стирола получают и довольно ценный оксид пропилена, который используют в других химических производствах. Рассматриваются также и возможности получения стирола в одностадийном процессе путем окислительного алкилирования бензола в присутствии ацетата палладия при 80°С и давлении 2,15 МПа:
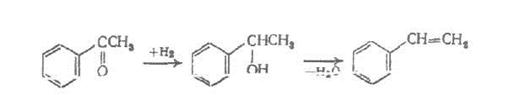
д) синтез стирола из этилбензола.
Для получения стирола проводят дегидратацию этилбензола. Она проходит согласно уравнения реакции:
![]()
![]()
Процесс проводят в
присутствии катализатора. Наибольшее применение нашли катализаторы на основе
оксида железа. Оптимальная температура при работе на этих катализаторах - ![]() ,
равновесный выход стирола не превышает 40-50 %. Для более полного превращения
этилбензола в стирол понижают парциальное давление паров этилбензола, разбавляя
его водяным паром (массовое отношение водяной пар : этилбензол 2,5 – 3 : 1).
,
равновесный выход стирола не превышает 40-50 %. Для более полного превращения
этилбензола в стирол понижают парциальное давление паров этилбензола, разбавляя
его водяным паром (массовое отношение водяной пар : этилбензол 2,5 – 3 : 1).
е) хлорирование стирола.
Группу –СН=СН2 в молекуле стирола можно отнести к заместителям первого рода. Они имеют электронодонорные свойства.
При хлорировании стирола в отсутствии катализаторов галоген присоединится к боковой цепи согласно правила Бельштейна.
Если надо ввести галоген в ароматическое ядро, то используют катализаторы. Катализаторами выступают: FeCl3, AlCl3, SbCl3, SbCl5. роль катализатора заключается в создании положительного иона галогена, который осуществляет электрофильное замещение в бензольном ядре. В присутствии FeCl3 хлорирование идет по схеме:
FeCl3 + СІ2 = ![]()
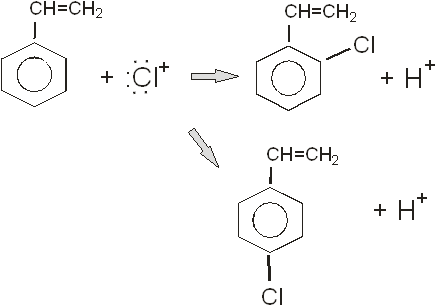
![]()
В данной реакции мы получим не только о-хлорстирол, но и п-хлорстирол, который изомерен первому. Выход данных продуктов реакции будет равен между собой и составит 50%.
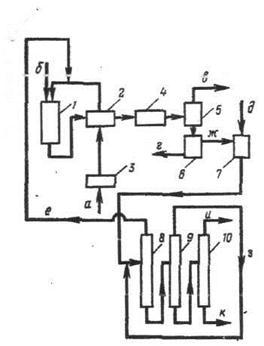
Установки для проведения синтеза о-хлорстирола и его промежуточных продуктов.
Рассмотрим процесс алкилирования бензола и получение этилбензола.
|
|
Рис. 2. Принципиальная схем алкилирования бензола на твердых катализаторах:
1 - теплообменник;
2 - реактор;
3 - холодильник;
4 - газосепаратор;
5, 6, 7 - ректификаторы,
а - бензол;
б - оборотный бензол;
в - олефин;
г -смесь бензола и олефина;
д - неконденсирующиеся газы;
в - жидкий алкилат;
ж - моноалкилбензол;
з - диалкилбензолы;
и - кубовый остаток.
Технологическая схема алкилирования бензола на твердом гетерогенном катализаторе, например цеолите, довольно несложна (рис. 2) [4, 5]. По этой схеме непрореагировавшие бензол и диэтилбензол возвращаются на алкилирование, а кубовый остаток может служить топливом и вместе с отходящими газами обеспечивает потребности установки в топливе (на 60%). В процессе отсутствуют отходы, катализатор не вызывает коррозии и не загрязняет окружающей среды.
Однако, пока что во всем мире наиболее широко в качестве катализаторов применяют комплексные соединения хлорида алюминия с ароматическими углеводородами, несмотря на такие их существенные недостатки, как необходимость осушки сырья, образование хлористого водорода и хлорида натрия при промывке и нейтрализации алкилата, коррозия аппаратуры и необходимость очистки сточных вод. Использование в большей мере хлорида алюминия вызвано и тем, что он является катализатором не только алкилирования, но и диспропорционирования, что снижает выход неизбежно образующихся при алкилировании ди- и полиалкилпроизводных. На практике используют жидкий катализаторный комплекс – хлорид алюминия в диэтилбензоле или в полиалкилбензольных фракциях, получаемых при алкилировании. Действие хлорида алюминия усиливается сокатализаторами, в качестве которых используют хлороводород или небольшие количества воды. Однако, чтобы избежать разложения катализатора, бензол тщательно сушат перед подачей на алкилирование.
Принципиальная схема процесса с использование катализаторных комплексов приведена на рисунке 3.
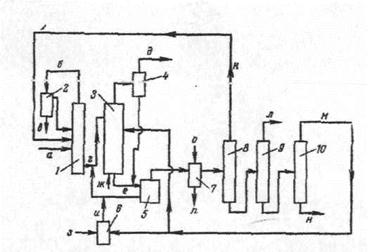
Рис. 3. Принципиальная схема получения этилбензола при использовании катализаторного комплекса.
1 колонна обезвоживания,
2 - сепаратор,
3 - реактор;
4 газосепаратор,
5 - сепаратор для отделения катализаторного комплекса;
6 - блок приготовления свежего катализаторного комплекса;
7 - система промывки алкилата;
8, 9,10 - ректификационные агрегаты;
а - исходный бензол;
б - азеотропная смесь вода + бензол;
в - вода;
г - обезвоженный бензол;
д -газы;
е - циркулирующий катализаторный комплекс;
ж - этилен;
з - хлорид алюминия;
и - свежий катализаторный комплекс;
к - оборотный бензол;
л - этилбензол;
м - диэтилбензол;
н - кубовый остаток;
о - вода на промывку;
п - сточные воды.
При получении этилбензола алкилирование ведут с избытком бензола (200 – 300% от стехиометрического), чтобы уменьшить образование ди- и полиалкилбензолов. И все же содержание последних оказывается значительным. Диалкилпроизводные подвергаются переалкилированию в реакторе алкилирования. Но можно непосредственно использовать их в качестве товарных продуктов.
В процессе алкилирования бензола с хлоридом алюминия циркулируют значительные объемы жидкого катализаторного комплекса. Причем в реакционной массе две жидкие фазы: катализаторный комплекс и смесь бензола и алкилбензолов. В результате возможность подъема температуры процесса ограничена, так как при температурах выше 130 °С комплекс дезактивируется и разрушается (3, 6).
Более интересно гомогенное алкилирование в присутствии хлорида алюминия. В этом случае количество катализатора определяется его растворимостью в бензоле, а давление процесса подирается таким, чтобы олефин находился в жидкой фазе.
Реактор работает в адиабатическом режиме, и на выходе из него температура достигает 200 °С. При этом резко уменьшился выход побочных продуктов, а выход этилбензола стал близок к количественному.
По такой технологии работает установка мощностью 760 тыс. т/год. Ее особенностью является высокий выход продуктов алкилирования (99%) и более низкие удельные затраты хлорида алюминия (в два раза) по сравнению с обычным процессом. В схеме отсутствует рецикл катализатора. Последний выделяется при нейтрализации в виде гидроксида алюминия и используется на установках очистки сточных вод в качестве осадителя. Большая единичная мощность установки в сочетании с высокой температурой в реакторе создает благоприятные условия для утилизации тепла реакции, в результате 90% потребности в тепловой энергии установка покрывает за счет использования названного тепла.
Рассмотрим технологическую схему получения стирола.
|
|
Ряс. 2. Принципиальная схеме получения стирола:
1 контактный аппарат;
2 теплообменник;
3 подогреватель;
4 холодильник;
5 газосепаратор;
6 сепаратор воды;
7 смеситель;
8, 9, 10 ректификационные агрегаты;
а бензол;
б –. водяной пер;
в водородсодержащие газы;
г вода;
д ингибитор;
е оборотный бензол;
ж «печное масло»;
л стирол-сырец;
ы товарный стирол;
к – кубовый остаток.
Этилбензольная шихта
подогревается в теплообменнике до 70-95![]() за счет теплоты химически
загрязненного конденсата и подается в испаритель вместе с небольшим количеством
водяного пара. Из испарителя пары шихты с температурой 160
за счет теплоты химически
загрязненного конденсата и подается в испаритель вместе с небольшим количеством
водяного пара. Из испарителя пары шихты с температурой 160![]() поступают в
перегреватель, где перегреваются до 500-550
поступают в
перегреватель, где перегреваются до 500-550![]() за счет теплоты перегретого
водяного пара, выходящего из межступенчатого подогревателя реактора. Из
перегревателя пары шихты направляются на дегидрирование в реактор. Теплота,
необходимая для реакции, подводиться с водяным паром, перегретым в печи до
700-750
за счет теплоты перегретого
водяного пара, выходящего из межступенчатого подогревателя реактора. Из
перегревателя пары шихты направляются на дегидрирование в реактор. Теплота,
необходимая для реакции, подводиться с водяным паром, перегретым в печи до
700-750![]() .
.
Пароэтилбензольная смесь
на входе в реактор имеет температуру 560-630![]() . За счет эндотермической
реакции после первого реактора температура контактного газа снижается до 570
. За счет эндотермической
реакции после первого реактора температура контактного газа снижается до 570![]() . Контактный
газ из реактора поступает в межступенчатый подогреватель, где подогревается до
580-630
. Контактный
газ из реактора поступает в межступенчатый подогреватель, где подогревается до
580-630![]() ,
и затем направляется во второй реактор. Контактный газ из реактора с
температурой 570
,
и затем направляется во второй реактор. Контактный газ из реактора с
температурой 570![]() поступает в
котел-утилизатор. Охлажденный до 180-200
поступает в
котел-утилизатор. Охлажденный до 180-200![]() контактный газ из
котла-утилизатора направляется в пенный аппарат, где происходит дальнейшее
охлаждение контактного газа и отмывка его от механических примесей.
контактный газ из
котла-утилизатора направляется в пенный аппарат, где происходит дальнейшее
охлаждение контактного газа и отмывка его от механических примесей.
Охлажденный контактный газ поступает на конденсацию. Конденсация осуществляется последовательно в нескольких конденсаторах. Полученные конденсаты стекают в отстойную емкость, где происходит расслаивание на водный и углеводородные слои. Верхний углеводородный слой, называемый печным маслом, самотеком поступает в сборник, где заправляется ингибитором гидрохиноном, и направляется на ректификацию. Нижний водный слой – химически загрязненный конденсат – собирается в емкость и насосом подается на отмывку контактного газа в пенный аппарат, откуда конденсат после охлаждения в теплообменнике направляется на очистку от механических примесей. Несконденсировавшийся газ после конденсаторов компримируется и поступает в линию топливного газа.
Основным процессом получения стирола в промышленности остается каталитическое дегидрирование. Увеличению равновесного выхода стирола благоприятствует повышение температуры и понижение давления. Поэтому дегидрирование ведут при температуре около 600°С, используя разрежение или подачу острого пара. Выход стирола за проход составляет 25–35%. Катализатором служат смеси оксидов железа и хрома, продотированные, например, карбонатом калия. Ректификация стирола-сырца проводится в вакууме при добавлении ингибиторов полимеризации. Принципиальная схема процесса представлена на рис. 2. Сравнительно небольшая разница температур кипения стирола и этилбензола требует применения высокоэффективных ректификационных колонн.
Лучшие современные предприятия по производству стирола характеризуются следующими расходными показателями на 1 т стирола:
Этилен, т .... 0,307
Бензол, т........ 0,820
Пар (Р=О,53 МПа) . .1,70
Электроэнергия, кВт-ч 65
Топливо, ГДж . . .6,35
Перспективным методом производства стирола является окислительное дегидрирование этилбензола диоксидом серы – необратимый процесс, малочувствительный к примесям, содержащимся в этилбензоле, и позволяющий получить стирол с высоким выходом. Перспективен и процесс сопряженного окислительного дегидрирования, по которому получают стирол и оксид пропилена [ 4, с. 206 –207]. По этой технологии сооружен ряд крупных производств, в частности в Нидерландах.
Очистка и идентификация полученного вещества.
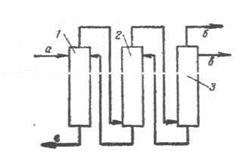 В промышленности для выделения о-хлорстирола
из смеси изомеров (п-хлорстирол) используют ректификационные колонны (рис. 2) с
большим числом тарелок: 300 – 450.
В промышленности для выделения о-хлорстирола
из смеси изомеров (п-хлорстирол) используют ректификационные колонны (рис. 2) с
большим числом тарелок: 300 – 450.
Рис. 2.
На рисунке приведена схема очистки и выделения о-хлорстирола из смеси изомеров.
1, 2, 3 ректификационные колонны,
а) сырье на разделение.
б) головная фракция,
в) о-хлорстирол.
г) другие продукты.
Ректификацию проводят на трех последовательно расположенных колоннах с числом тарелок в каждой 130 – 150. Капитальные затраты по сравнению с работой на одной колонне аналогичной суммарной эффективности безусловно выше, но эксплуатационные расходы ниже.
Кратность орошения при выделении о-хлорстирола составляет 60 – 100, отбор от потенциала находится на уровне 70 – 90%.
Полученный о-хлорстирол можно идентифицировать по продуктам сгорания, среди которых должен находится хлороводород, а также по реакциям присущим стиролу, то есть окислению, присоединению водорода и галогенов в боковую цепь.
Техника безопасности при получении и хранении о-хлорстирола.
При получении о-хлорстирола используют многие органические вещества, многие из которых сильно токсичны (бензол) или огнеопасны, например, метан, этилен. Также используются высокие давления и температуры в химических реакторах. Поэтому надо соблюдать все необходимые по меры безопасности, рабочие должны пройти необходимый инструктаж и иметь необходимые допуски к работе с высокими давлениями и токсичными и легкогорючими веществами.
О-хлорстирол является органическим веществом и производным бензола. Поэтому он, как и другие органические вещества горюч. При горении выделяют раздражающие или токсичные пары (или газы). Поэтому важно не допускать открытого огня и искр. Тушить горящий о-хлорстирол можно порошком, разбрызгиванием воды, пеной, двуокисью углерода.
При температуре выше 58°C могут образоваться взрывоопасныe смеси состоящие из паров о-хлорстирола и воздуха.
В случае пожара надо сохранять бочки с веществом охлажденными, обливая их водой или пенными растворами.
При температурах выше 58° C применять закрытую систему вентиляции, защищенное от взрыва электрооборудование.
О-хлорстирол является умеренно токсичным, поэтому при работе с ним надо соблюдать осторожность, не допускать попадания капель вещества на незащищенные участки кожи. Следует также соблюдать осторожность и не допускать вдыхания паров вещества.
Для рабочих зон химических предприятий приняты следующие нормативы содержания 0-хлорстирола в воздухе:
TLV(предельная пороговая концентрация, США) : 50 ppm
TWA (среднесменная концентрация, США); 75 ppm
Российские нормативы: максимально разовая ПДК в воздухе рабочей зоны 50мг/м3. Класс опасности: 4
Согласно полученным данным вещество может всасываться в организм при вдыхании паров. Опасное загрязнение воздуха будет достигаться довольно медленно при испарении этого вещества при 20°C. При кратковременном воздействии на организм вещество раздражает глаза и кожу.
Ароматические углеводные токсичны, имеют наркотическое действие, но некоторые могут вызвать возбуждение, судороги. Поступают в организм преимущественно через легкие, на слизистую оболочку и кожу действуют раздражающе. Высокие концентрации ароматических углеводородов, в частности, бензола, могут вызвать потерю сознания, и даже смерть на протяжении нескольких минут. При отравлении высокими концентрациями бензола слизистые оболочки становятся вишнево-красного цвета, а лицо – земленисто- синюшнього цвета. Меньшие концентрации вызывают возбуждение, галлюцинации, а потом сонливость, общую слабость, дурноту, рвоту, потерю сознания. Появляются подергивания, которые переходят в судороги. Повреждаются кроветворные органы.
Вдыхание паров о-хлорстирола приводит к головокружению, чувству слабости, жалобам на головной боль, потере сознания, синюшности лица, возможны перебои в работе сердца. При отравлении необходимо вывести пострадавшего на чистый воздух или в хорошо вентилируемое помещение. Вызвать медицинскую помощь. В случае ослабления или остановки дыхания – искусственная вентиляция легких, покой, согревание тела, горчичники на руки и ноги, оксигенотерапия. Внутривенно вводят глюкозу (30 – 40 мл 40 % раствора), проводят витаминотерапию (цианокобаламин - до 1000 мкг, 5 % раствор тиамина хлорида и пиридоксин гидрохлорида – до 3 мл внутривенно. При возбуждении назначают успокоительные средства, а также средства, которые нормализуют дыхание и деятельность сердечно-сосудистой системы. При отравлении через рот промывают желудок, дают адсорбенты (активированный уголь), солевое слабительное. Рвотные средства противопоказаны.
Для недопущения отравлений использовать средства защиты органов дыхания, респираторы и противогазы. При больших концентрациях – противогаз с принудительной подачей воздуха. При небольших концентрациях противогаз марки А или М. Спецодежа хлопчатобумажная с хлорвиниловым покрытием. При работе использовать безискровой инструмент и такие же фонари.
При попадании о-хлорстирола на открытую кожу наступает покраснение последней. Для лечения и профилактики дальнейшего отравления пораженные участки промыть теплой водой с мылом. Для профилактики использовать в работе с веществом защитную одежду или хотя бы защитные перчатки и очки, особо следует опасаться попадания вещества на слизистые оболочки глаз и ротовой полости. Для лечения используется промывание большим количеством воды в течение нескольких минут (снять контактные линзы, если это не трудно), затем доставить к врачу.
Хранение вещества допускается только в защищенном от огня месте. Хранить в хорошо проветриваемом помещении. На холоде. Хранение допускается только в стабилизированном состоянии.
При ликвидации утечек надо немедленно удалить все источники огня. В помещении создать хорошо вентилированную атмосферу и не допускать возникновения опасных концентраций 0-хлорстирола. Поскольку это может привести в возможности взрыва паро – воздушной смеси. Собрать подтекающую жидкость в герметичные контейнеры. Засыпать оставшуюся жидкость песком или инертным абсорбентом, собрать и удалить его в безопасное место. При работе необходимо использовать дополнительную личную защиту: фильтрующий респиратор для органических газов и паров, а также спецодежду.
В работе было детально рассмотрено производство такого вещества как о-хлорстирол из метана. Мы рассмотрели основные этапы его получения, особенности производства и технологические схемы.
Как видно получение о-хлорстирола из метана – это довольно сложный и многостадийный химический процесс. И надо отметить что в наше время бензол чаще получают не из метана, а из каменноугольной смолы при коксировании угля или из продуктов каталитического риформинга нефти при ее переработке. Получение бензола из метана возможно и в некоторых странах (США, Германия) существуют опытные установки по его получению, но они не настолько экономически выгодны для массового использования. Пока что бензола и его производных для промышленного использования хватает и при использовании старых методов получения.
Возрастание производства пластиков, синтетических волокон и каучуков (особенно с улучшенными свойствами, кислотоустойчивых материалов для химической промышленности) в будущем может привести к необходимости расширить сырьевую базу для получения бензола, тогда-то производство последнего из метана природного газа и станет востребованным. Тогда – то и будет практически осуществлен тот путь получения о-хлорстирола, который найдет свое применение в производстве новых марок кислото- и морозоустойчивых каучуков, искусственных волокон и пластмасс.
Список использованной литературы.
1. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
2. Рабинович В. А., Хавин З. Я. Краткий химический справочник. – Л.: Химия, 1978. – 331 с.
3. Химия: Справочное издание/ под ред. В. Шретер, К.-Х, Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. М.: Химия, 1989.– 648 с.
4. Химическая энциклопедия в 5 т. / под ред. И. Л. Кнунянца. – М.: Советская энциклопедия, 1990.
5. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1988.
6. Ошанина О.В., Брук Л.Г., Темкин О.Н. Альтернативные методы получения продуктов основного органического синтеза. – М.:МИТХТ, 2002.
© 2010 Интернет База Рефератов