
Рефераты по сексологии
Рефераты по информатике программированию
Рефераты по биологии
Рефераты по экономике
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Рефераты по авиации и космонавтике
Рефераты по административному праву
Рефераты по безопасности жизнедеятельности
Рефераты по арбитражному процессу
Рефераты по архитектуре
Рефераты по астрономии
Рефераты по банковскому делу
Рефераты по биржевому делу
Рефераты по ботанике и сельскому хозяйству
Рефераты по бухгалтерскому учету и аудиту
Рефераты по валютным отношениям
Рефераты по ветеринарии
Рефераты для военной кафедры
Рефераты по географии
Рефераты по геодезии
Рефераты по геологии
Рефераты по геополитике
Рефераты по государству и праву
Рефераты по гражданскому праву и процессу
Рефераты по делопроизводству
Рефераты по кредитованию
Рефераты по естествознанию
Рефераты по истории техники
Рефераты по журналистике
Рефераты по зоологии
Рефераты по инвестициям
Рефераты по информатике
Исторические личности
Рефераты по кибернетике
Рефераты по коммуникации и связи
Курсовая работа: Изучение процесса восстановления серебра в водных растворах
Курсовая работа: Изучение процесса восстановления серебра в водных растворах
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
ИЗУЧЕНИЕ ПРОЦЕССА ВОССТАНОВЛЕНИЯ СЕРЕБРА В ВОДНЫХ РАСТВОРАХ
Курсовая работа по неорганической химии
Студент 4 курса Е.А. Вишнякова
Оценка «____»
Руководитель, доцент, к.х.н. С.В. Сайкова
Оценка защиты «_____»
Итоговая оценка «_____»
Зав.кафедрой неорганической химии Н.Н.Головнев
Красноярск 2008
СОДЕРЖАНИЕ
Введение 3
1 Литературная часть 5
1.1 Применение наночастиц серебра 5
1.2 Основные методы получения наночастиц серебра 6
1.2.1 Получение наночастиц серебра методом химического восстановления в растворах 6
1.2.1.1 Получение наночастиц серебра методом фотолиза 7
1.2.1.2 Получение наночастиц серебра с помощью лазерного
излучения 9
1.2.1.3 Радиационно-химическое восстановление ионов металлов в водных растворах. Образование золей металла 9
1.3 Свойства наночастиц серебра 10
1.4 Методы исследования наночастиц 13
2 Экспериментальная часть 15
2.1 Оборудование и реактивы 15
2.2 Методы исследования 15
2.2.1 Получение наночастиц серебра 15
2.2.2 Приготовление раствора на основе фармацевтического препарата «Аскорбиновая кислота с глюкозой» 16
2.3 Обсуждение результатов 16
2.3.1 Изучение влияния концентрации нитрата серебра
на величину плазмонного пика 17
2.3.2 Изучение влияния рН на величину плазмонного пика 20
2.3.3 Исследование влияния концентрации восстановителя –
глюкозы на свойства получаемых наночастиц серебра 22
Выводы 23
Список литературы 24
ВВЕДЕНИЕ
В последние годы интерес к изучению и получению наноразмерных частиц существенно возрос. Это связано с тем, что открылись новые перспективные возможности использования наноматериалов во многих областях науки и техники, в частности, для получения эффективных и избирательных катализаторов, для создания элементов микроэлектронных и оптических устройств, для синтеза новых материалов. Растворы золей металлов, преимущественно золота, серебра и металлов платиновой группы, интенсивно изучались в прошедшем столетии. Среди вариантов их получения преобладают методы, основанные на восстановлении ионов металлов в растворах в присутствии высокомолекулярных соединений и ПАВ в качестве стабилизаторов, и приемы испарения и конденсации металлов. В начале 1990-х годов применение радиационно-химического метода восстановления позволило получить такой химически активный металл как кадмий в коллоидной форме в водном растворе и изучить его электронные, оптические и другие свойства. Разработанный подход оказался продуктивным и его применение дало возможность за короткий срок существенно расширить круг металлов, получаемых в наноразмерном состоянии в водных растворах.
Есть все основания полагать, что интерес к наноразмерным частицам будет сохраняться еще длительное время и это вызвано тем, что они занимают промежуточное положение между атомно-молекулярным и конденсированным состояниями вещества [1]. Из этого факта вытекают необычные их свойства. Фундаментальными задачами остаются установление их электронной структуры, характера взаимодействия со средой, изучение состояния поверхности и её влияния на устойчивость наночастицы, способности оказывать каталитическое действие на протекание разнообразных химических реакций и др. Целью данной работы являлось изучение процесса восстановления серебра в водных растворах и определение оптимальных условий синтеза наночастиц серебра.
Глава 1 ЛИТЕРАТУРНАЯ ЧАСТЬ
1.1 Применение наночастиц серебра
Наночастицы не разрушаются при действии длительного облучения. Это их свойство нашло широкое применение в сфере изучения различных биологических процессов и природы явлений. Поэтому, наночастицы могут быть использованы для постоянного контроля динамики процессов в клетках живых организмов от недели до месяца. Одним из наиболее важных направлений, в области применения биомаркеров, является их использование для поиска средств для диагностики рака. Когда наночастицы серебра объединяются с раковыми антителами, раковые клетки становятся «мечеными» и каждая клетка может быть обнаружена с помощью обычного микроскопа, благодаря «усилению» их свойств.
Типичные наночастицы серебра имеют размеры 25 нм. Они имеют чрезвычайно большую удельную площадь поверхности, что увеличивает область контакта серебра с бактериями или вирусами, значительно улучшая его бактерицидные действия. Таким образом, применение серебра в виде наночастиц позволяет в сотни раз снизить концентрацию серебра с сохранением всех бактерицидных свойств. Бактерицидная добавка на основе наночастиц серебра является одним из последних достижений отечественной науки в области нанобиотехнологий.
После длительного использования, терапевтическая ценность синтетических антибиотиков уменьшилась из-за появления устойчивых к ним микроорганизмов. Развитие сопротивляемости микроорганизмов к антибиотикам может произойти из-за непосредственной мутации микроорганизма, а также из-за приобретения частей ДНК от других организмов. Уже на протяжении тысячелетий бактерии и вирусы не способны выработать "иммунитет" к серебру. В то время как серебро полностью безопасно для млекопитающих (в том числе человека), рептилий, растений и всех других живых существ, имеющих многоклеточное строение.
В связи со способностью особым образом модифицированных наночастиц серебра длительное время сохранять биоцидные свойства, рационально использовать наносеребро не в качестве дезинфицирующих средств частого применения, а добавлять в краски, лаки и другие материалы, что позволяет экономить деньги, время и трудозатраты.
1.2 Основные методы получения наночастиц серебра
1.2.1 Получение наночастиц серебра методом химического восстановления в растворах
Наночастицы серебра в водных растворах получают путем восстановления ионов серебра с помощью глюкозы, аскорбиновой кислоты, гидразина, боргидрида натрия и других восстановителей. Реакцию восстановления проводят в различных условиях. Восстановление глюкозой проводят при нагревании до 600С. Для увеличения скорости протекания реакции используют гидроксид натрия. Полученные частицы исследуют различными способами: методом рентгеновской дифракции (XRD), методом трансмиссионной электронной микроскопии (TEM), а также проводились исследования на спектрофотометре. Исследования показали, что в ходе восстановления в водных растворах были получены частицы размером 10 – 20нм, λ = 1.5418 A°
К способам управления размерами наночастиц, применяемым в научной практике, относятся: использование полимерных матриц, позволяющих управлять размерами нанокластеров, полимерной защиты; физические методы управления размерами (обработка ультразвуком, облучение рентгеновским излучением и использование токов высокой чистоты). Изменение размера нанокластеров металлов добиваются также варьированием природы восстановителя [3]. Так, использование боргидрида натрия при восстановлении позволяет в большинстве случаев получить наночастицы серебра с узким распределением по размерам в пределах 2-8 нм. Восстановление более мягким восстановителем, таким как гидразин, приводит к образованию более крупных наночастиц металлов с размерами 15-30 нм. При варьировании условий восстановления возможно получение практически монодисперсных наночастиц. Строение и размер продукта в большой степени зависит от условий реакции таких как температура и концентрация нитрата серебра. Например, когда температура понижается до 120 или увеличивается до 190, в полученном продукте доминируют наночастицы с нерегулярной структурой (формой). Начальная концентрация нитрата серебра должна быть не больше 0.1М, в противном случае будет выпадать в виде осадка металлическое серебро. Наночастицы серебра с различными размерами могут быть получены в результате увеличения времени проведения реакции.
Для исследования влияния рН на устойчивость водных коллоидных растворов, раствор нитрата серебра был предварительно обработан и его значение рН установлено по растворам NaOH и HCl. Процесс восстановления серебра шел замедленно в сильнокислых (рН 1.5) и в основных (рН 12.5) условиях. Коллоидный раствор в щелочной среде сохраняет устойчивость в течении больше, чем 2 недели без образования осадка. В то время как в кислотных условиях подобная стабильность не наблюдается, образовавшиеся агригаты сохраняются лишь в течении 5 дней при рН 1.5.
Также известны способы получения наночастиц серебра в неводных средах. Наночастицы серебра с фиксированным размером были синтезированы с помощью модифицированного высокомолекулярного процесса, который предполагает восстановление нитрата серебра с этиленгликолем в присутствии стабилизаторов, таких как поливинилпирролидон [4]. Несмотря на то, что принцип селективности для этих систем еще не полностью изучен, предполагают, что селективная адсорбция ПВП на различных кристаллографических плоскостях серебра определяет морфологию продукта.
Оптические измерения коллоидных наночастиц серебра в этаноле показывают единственный максимум при длине волны 395нм, который связан с поверхностным плазмонным резонансом. Это и соответствует сферическим наночастицам серебра размером 5-8нм. Наблюдался процесс разрушения наночастицы при прохождении через энергетический барьер: должно накопиться необходимое для разрушения наночастицы количество энергии и, одновременно, проникнуть в запрещенную энергетическую зону и индуцировать многофотонный процесс.
1.2.1.1 Получение наночастиц серебра методом фотолиза
Процесс фотолиза, с помощью лазерного возбуждения, также может быть использован для получения наночастиц серебра в коллоидных растворах. Камат [5] в своей работе предполагал, что в процессе фотолиза наночастицы серебра теряют электроны за счет фотоэжекции, образуя переходное состояние, которое предшествует окончательному разделению больших частиц. Таками [5] считал, что уменьшение размера частиц наблюдается после облучения нановторичными Nd:YAG лазерными импульсами. Это объясняется частичным нагревом, плавлением и испарением поверхностного слоя. Моханти [5] предполагал, что лазерное облучение разбивает наночастицы серебра на мельчайшие фрагменты, которые снова образуют частицы новых размеров. Таким образом, основным способом контроля размера образующихся наночастиц является облучение.
1.2.1.2 Получение наночастиц серебра с помощью лазерного излучения
В последние несколько лет для получения коллоидных частиц металлов использовалось лазерное облучение. Для элементов, в первых работах Мафуна [5], было показано, что получение наночастиц с помощью лазера, может быть выполнено в растворах, эта возможность используется металлическими коллоидными частицами, без учета ионов в конце процесса образования наночастиц. Изучается возможность расширения этого процесса для большего числа различных растворителей отличных от воды, что было представлено в работах Амондола [6], который предложил способ контролирования металлических кластерных соединений за счет переизлучения, мониторинга результатов с помощью исследования оптических свойств. Совсем недавно исследовалось прямое влияние лазерного излечения на золото-серебряную коллоидную смесь, что дало новые способы получения сплавов наночастиц.
Контроль размера, формы и структуры металлических наночастиц технологически важны из-за сильных корреляций между этими параметрами и оптическими, электрическими и кристаллическими свойствами.
1.2.1.3 Радиационно-химическое восстановление ионов металлов в водных растворах. Образование золей металла [5]
Радиационно-химическое восстановление (или окисление) ионов металлов в водных растворах осуществляется ионными и радикальными частицами, которые генерируются под действием ионизирующего излучения.
Атомы и ионы в необычных и неустойчивых состояниях окисления, образующиеся на начальном этапе восстановления ионов металлов в водном растворе, являются источником формирования наночастиц.
Радиационно-химическое восстановление многих ионов металлов в водных растворах в присутствии стабилизаторов приводит к образованию золей металла. Этот способ получения металлических наночастиц имеет ряд несомненных преимуществ, что обеспечило его достаточно широкое применение. К числу достоинств можно отнести, по крайней мере, следующие. Во-первых, вводимые в исходный раствор добавки не загрязняют образующиеся металлические золи, что неизбежно при использовании NaBH4 и других восстановителей. Во-вторых, при облучении радикалы-восстановители генерируются равномерно по объему
раствора, что позволяет избежать локальных пересыщений, создаваемых при обычном проведении восстановительной реакции. В-третьих, простота проведения эксперимента: реакционный сосуд с вакуумированным раствором помещают на источник излучения, восстановительный процесс заканчивается после удаления раствора от источника излучения. В-четвертых, приготовленные растворы, содержащие в необходимой концентрации органические соединения, практически прозрачны даже в глубоком ультрафиолетовом свете, что позволяет успешно применять для исследования золей наиболее информативный метод электронной спектроскопии.
Радиационно-химический метод полезно дополняет другие приемы получения металлических наночастиц (фотохимические, электрохимические, сонохимические и др.); использование для этих целей разнообразных восстановителей и стабилизаторов; восстановление в обратных мицеллах и многие другие.
1.3 Свойства наночастиц серебра
Свойства коллоидного раствора, в том числе и наночастиц серебра, определяются возможностью коагуляции и перекресталлизации, т. е. агрегативной устойчивостью, а также седиментационной устойчивостью и возможностью их окисления кислородом воздуха. Анализ литературных данных показал, что для описания устойчивости нанодисперсии серебра во времени могут быть использованы несколько методов. Метод визуального наблюдения за системой может дать предварительные и общие закономерности относительной устойчивости исследуемой дисперсии. Может быть зафиксировано изменения окраски системы и/или образования осадка в ней. Для наночастиц серебря цвет систем от красного (желто-коричневого) меняется до серого и даже черного. Визуальный метод наблюдения может сыграть определяющую роль при исследовании седиментационной устойчивости.
Было найдено [7], что при радиационно-химическом восстановлении ионов Ag+ в присутствии наночастиц гетерополисоединений в оптическом спектре возникают полоса золя металла с максимумом при 392 нм и полоса при 650 нм, обусловленная продуктом восстановления («синь»).
Напуск воздуха приводит к окислению «сини», интенсивность полосы наночастиц серебра при этом существенно уменьшается и смещается в длинноволновую область (λмакс = 410 нм). Повторное γ-облучение раствора восстанавливает предшествующий спектр поглощения. Указанную процедуру «окисления-восстановления» можно провести несколько раз, при этом достигаются те же оптические эффекты. Таким образом, восстановление гетерополисоединения, составляющего стабилизирующий слой наночастицы серебра, обеспечивает повышение электронной плотности на металлическом ядре, что вызывает увеличение интенсивности полосы поглощения и ее «синее» смещение. Соответственно, окисление приводит к обратному эффекту.
Анализируя спектры поглощения, можно предположить, что появление дополнительной полосы поглощения в длинноволновой части спектра говорит о возможной коагуляции и перекристаллизации, происходящих в системе. Агрегативную устойчивость можно охарактеризовать при помощи метода электронной микроскопии. Он позволяет получить распределение частиц по размерам и формам, а также дает представление о расположение наночастиц в пространстве (несвязанные, коагулированные).
Согласно теории Ми.Друде [8] (Mie.Drude) положение максимума полосы поглощения поверхностных плазмонов в металле определяется по уравнению:
λ2макс = (2πc)2m(ε0 + 2n)/4πNе e2 (1)
где c - скорость света; m - эффективная масса электрона; e - заряд электрона; ε0 – диэлектрическая проницаемость металла; n - показатель преломления среды; Ne - плотность свободных электронов в металле.
Рассеяние света мелкими частицами обусловливает широкий класс явлений, которые можно описать на основе теории дифракции света на диэлектрических частицах. Многие характерные особенности рассеяния света частицами удаётся проследить в рамках строгой теории, разработанной для сферических частиц английским учёным А. Лявом (1889) и немецким учёным Г. Ми (1908, теория Ми). Когда радиус шара r много меньше длины волны света ln в его веществе, рассеяние света на нём аналогично нерезонансному рассеянию атомом. Сечение (и интенсивность) рассеяния в этом случае сильно зависит от r и от разности диэлектрических проницаемостей e и e0 вещества шара и окружающей среды: s ~ ln—4r6(e - e0) (Рэлей, 1871). С увеличением r до r ~ ln и более (при условии e > 1) в индикатрисе рассеяния появляются резкие максимумы и минимумы — вблизи так называемых резонансов Ми (2r = mln, m = 1,2, 3) сечения сильно возрастают и становятся равными 6pr2 рассеяние вперёд усиливается, назад — ослабевает; зависимость поляризации света от угла рассеяния значительно усложняется.
Рассеяние света большими частицами (r >> ln) рассматривают на основе законов геометрической оптики с учётом интерференции лучей, отражённых и преломленных на поверхностях частиц. Важная особенность этого случая — периодический (по углу) характер индикатрисы рассеяния и периодическая зависимость сечения от параметра r/ln. Рассеяние на крупных частицах обусловливает ореолы, радуги, гало и др. явления, происходящие в аэрозолях, туманах и пр.
Рассеяние средами, состоящими из большого числа частиц, существенно отличается от рассеяния отдельными частицами. Это связано, во-первых, с интерференцией волн, рассеянных отдельными частицами, между собой и с падающей волной. Во-вторых, во многих случаях важны эффекты многократного рассеяния (переизлучения), когда свет, рассеянный одной частицей, вновь рассеивается другими. В-третьих, взаимодействие частиц друг с другом не позволяет считать их движения независимыми.
1.4 Методы исследования наночастиц
Для описания устойчивости нанодисперсии серебра во времени могут быть использованы несколько методов. Метод визуального наблюдения за системой может дать предварительные и общие закономерности относительно исследуемой дисперсии.
К надежным инструментальным методам относится оптический, основанный на измерении спектра поглощения. Анализируя спектры поглощения, можно предположить о возможности коагуляции и перекристаллизации при появлении дополнительной полосы поглощения на зависимости оптической плотности от длины волны или нового максимума в длинноволновой части спектра.
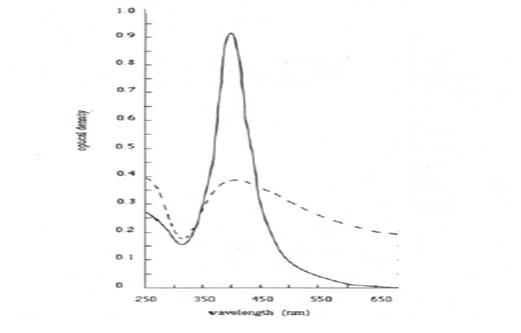
Рисунок 1. УФ-спектр наночастиц серебра в растворе
Также для характеристики свойств синтезированных нанодисперсных систем серебра используется просвечивающая электронная микроскопия. Компьютерный анализ полученных изображений наночастиц дал возможность получить распределение частиц по размерам при различных условиях проведения синтеза.
Атомно-абсорбционная спектроскопия позволила определить концентрацию ионов серебра в системах.
Глава 2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Оборудование и реактивы
Растворы концентрация
AgNO3 5*10-3M; 1*10-3M; 5*10-4M; 1*10-4M;
C6H12O6 1*10-2M; 1*10-3M;
C6H8O6 1*10-2M; 2*10-2M;
NaBH4 1*10-2M;
NH3*H2O 25%;
Фармацевтический препарат
«Аскорбиновая кислота
с глюкозой». ГОСТ-000906.05
Все реактивы, используемые в работе имели квалификацию ч.д.а. и дальнейшей очистке не подвергались.
Использовали также следующее оборудование:
1. Аналитические весы лабораторные равноплечие 2 класса модели ВЛФ-200. Основная погрешность по шкале 0,15мг.
2. Колориметр фотоэлектрический Analytic jena;
3. рН – метр марки 150М;
4. Электрическая плитка «Фея-2»;
5. Микроволновая печь LG MS – 1724U.
2.2 Методы исследования
2.2.1 Получение наночастиц серебра
К раствору нитрата серебра определенной концентрации добавляли раствор восстановителя (глюкозы, аскорбиновой кислоты, боргидрида натрия, фарм.препарата «Аскорбиновая кислота с глюкозой»). Соотношение объемов 1:1. Приготовленные растворы подвергали нагреванию на плитке (t=96-98С) в течение 120мин и СВЧ облучению в микроволновой печи в течение 10 минут (режим max).
После синтеза гидрозоли серебра исследовались электронно-микроскопическим методом, а также визуально отмечалось изменение окраски растворов и/или образования осадка. Спектры поглощения Ag-гидрозоля регистрировали при комнатной температуре в области 300-700 нм на спектрофотометре Analiticjena (кювета (Q) – 1см).
2.2.2 Приготовление раствора на основе фармацевтического препарата «Аскорбиновая кислота с глюкозой»
Состав фармацевтического препарата: аскорбиновая кислота = 0,100г; глюкоза (декстроза) = 0,877г; крахмал = 0,023г. Расчет вели на 100мл раствора приготовленного на основе таблетки с учетом, что концентрация аскорбиновой кислоты = 0,02М. m(навески таблетки) = 3,5199г: m(аскорбиновой кислоты) = 0,3520г; m(глюкозы) = 3,0870г; m(крахмал) = 0,0896г. Таблетки растирали в фарфоровой ступке, взвешивали и растворяли в дистиллированной воде, после чего раствор фильтровали для удаления крахмала.
2.3 Обсуждение результатов
После проведенных исследований, было установлено, что эффективными восстановителями являются боргидрид натрия и глюкоза. В дальнейшем в работе использовался восстановитель глюкоза, так как он является более экологически безопасным. Также важно отметить, что визуально было отмечено различие в окраске, полученных растворов: при восстановлении боргидридом натрия раствор черного цвета, что свидетельствует о частицах серебра более крупного размера (ассоциация частиц); при восстановлении глюкозой раствор светло-коричневого(желтого) цвета, что указывает на наличие более мелких частиц серебра.
Полученные данные, а также спектры исходных растворов представлены на рисунках 2 – 5.
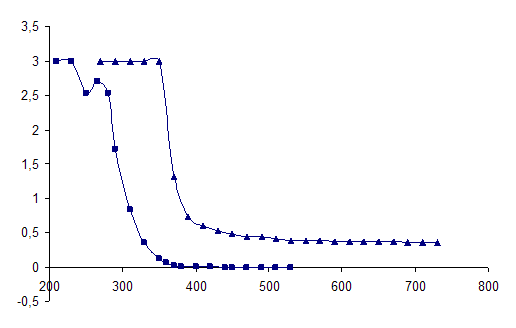
Рисунок 2 - Спектры оптического поглощения исходных растворов
(■ – аскорбиновой кислоты, ▲ – таблетки).
2.3.1 Изучение влияния концентрации AgNO3 на величину плазмонного пика
Приготовление растворов проводили в соответствии с методикой, указанной в п.2.2.1. Концентрацию растворов AgNO3 варьировали в интервале 0,0001М – 0,005М. Концентрация глюкозы была постоянна и равна 0,01М.
Полученные результаты представлены на рисунке 6.
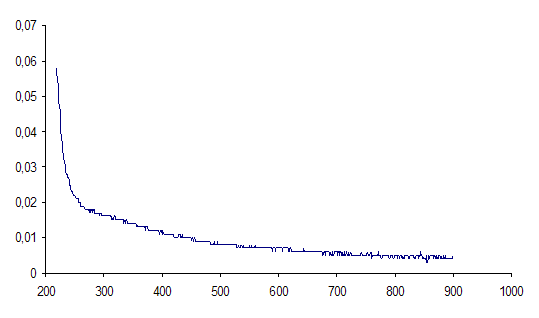
Рисунок 3 - Спектры оптического поглощения исходного раствора глюкозы
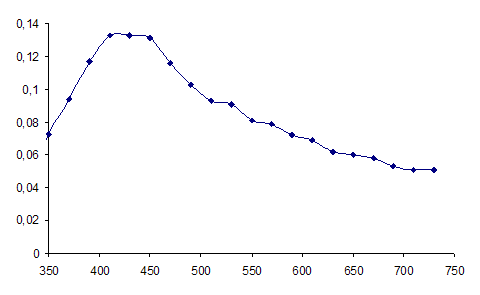
Рисунок 4 - Спектры оптического поглощения гидрозоля серебра, полученного восстановлением AgNO3 глюкозой.
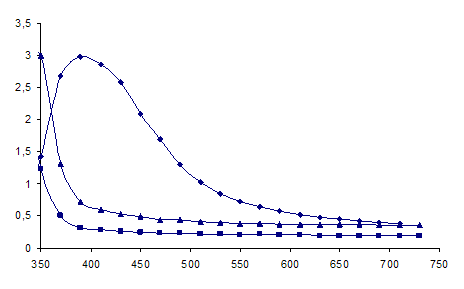
Рисунок 5 - Спектры оптического поглощения гидрозоля серебра, полученного восстановлением AgNO3 (■ аскорбиновой кислотой, ♦ - боргидридом натрия,
▲ – таблеткой).
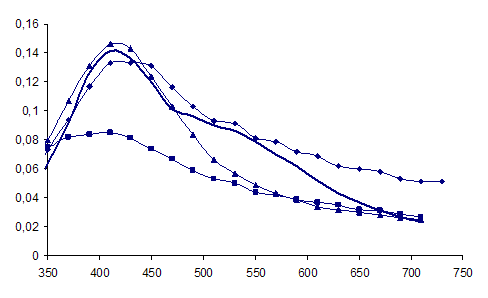
Рисунок 6 - Спектры оптического поглощения гидрозоля серебра, полученного восстановлением AgNO3 глюкозой(■ – С(AgNO3) = 0,0001М,
♦ - С(AgNO3) = 0,0005М, -- – С(AgNO3) = 0,001М;▲ С(AgNO3) = 0,005М).
Цвет раствора в зависимости от концентрации изменяется от прозрачного и бледно-желтого до ярко-желтого и коричневого. С ростом исходной концентраций ионов серебра наблюдается увеличение максимума поглощения при 420нм, что возможно связано с увеличением количества образующихся наночастиц.
2.3.2 Изучение влияния рН на процесс восстановления серебра
Приготовление растворов проводили в соответствии с методикой, указанной в п.2.2.1. рН растворов перед СВЧ облучением варьировали в интервале 5 – 11. Концентрации глюкозы и нитрата серебра были постоянны и равны соответственно 0,001М и 0,0005М.
Результаты представлены на рисунке 7.
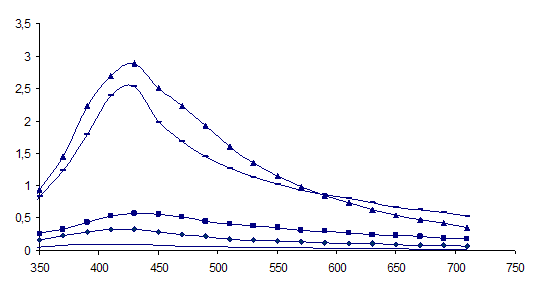
Рисунок 7 - Спектры оптического поглощения гидрозоля серебра, полученного восстановлением AgNO3 глюкозой(▲ – рН = 11,21; + - 10,24;
■ – рН = 8,34; ♦ - рН = 7,15; -- – рН = 5,16;).
Окраска полученных систем с увеличением значения рН изменялась от бледно-желтой (рН = 5,16) до темно-коричневой (рН = 11,21). Также следует отметить, что растворы с рН = 10,24 и рН – 11,21 являлись неустойчивыми: появлялась муть и практически сразу в осадок выпадало металлическое серебро.
Таким образом, из представленных графиков видно, что эффективное значение рН = 8,34, процесс восстановления идет более эффективно. Максимум поглощения наблюдается на длине волны λ = 420 нм. По литературным данным, это соответствует поглощению серебряных частиц размером несколько нанометров [4]. Быстрый рост поглощения в максимуме полосы свидетельствует о формировании в системе новых частиц серебра данного размера.
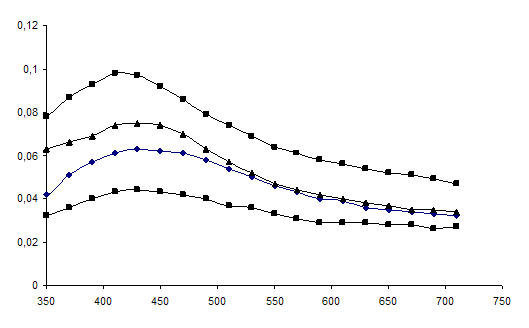
Рисунок 8 - Спектры оптического поглощения гидрозоля серебра, полученного восстановлением AgNO3 глюкозой (■ – С = 0,001М, ♦ - С = 0,005М, ▲ – С = 0,01М, + – С = 0,05М).
2.3.3 Исследование влияния концентрации восстановителя – глюкозы на свойства получаемых наночастиц серебра
Приготовление растворов проводили в соответствии с методикой, указанной в п.2.2.1. Концентрацию растворов глюкозы варьировали в интервале 0,001М – 0,05М. Концентрация нитрата серебра была постоянна и равна 0,005М.
Результаты представлены на рисунке 8.
Химическое восстановление является многофакторным процессом и зависит от подбора пары окислитель – восстановитель и их концентрации.
В работе проведено исследование влияния концентрации восстановителя – глюкозы на свойства получаемых наночастиц серебра. Прирост интенсивности в максимуме полосы поглощения при увеличении концентрации глюкозы, по-видимому, связан с повышением эффективности процесса восстановления Ag+.
ВЫВОДЫ
1. В ходе работы ознакомились с методами синтеза наночастиц серебра в водных растворах.
2. Провели синтез наночастиц серебра путем восстановления водного раствора нитрата серебра глюкозой. Определены оптимальные условия восстановления серебра: восстановитель – глюкоза; С(AgNO3) = 0,0001М; С(C6H12O6 ) = 0,05М; рН = 8,34.
СПИСОК ЛИТЕРАТУРЫ
1.Б.Г.Ершов Наночастицы металлов в водных растворах: электронные, оптические и каталитические свойства/Ершов Б.Г.//Журнал российского химического общества им. Д.И. Менделеева. – 2001. - Т. XLV, № 3.- С.5-9.
2. Meng Chen Preparation and Study of Polyacryamide-Stabilized Silver Nanoparticles through a One-Pot Process/ Meng Chen, Li-Ying Wang, Jian-Tao Han, Jun-Yan Zhang, Zhi-Yuan Li, Dong-Jin Qian//Department of Chemistry and Laboratory of AdVanced Materials, Fudan UniVersity. 2006. – С.34-38.
3. Кузьмина Л.Н. Получение наночастиц серебра методом химического восстановления/Л.Н.Кузьмина, Н.С.Звиденцова, Л.В Колесников// Журнал Российского химического общества им. Д.И. Менделеева. – 2007. - Т. XХХ, № 8. – С.7 -12.
4. Сергеев Б.М.. Получение наночастиц серебра в водных растворах полиакриловой кислоты/ Б.М.Сергеев, М..В. Кирюхин, А.Н.Прусов, В.Г Сергеев // Вестник Московского Университета. Серия 2. Химия – 1999. – Т.40, №2. – С. 129-133.
5. Lilia Coronato Courrol A simple method to synthesize silver nanoparticles by photo-reduction/ Lilia Coronato Courrol, Fl´avia Rodrigues de Oliveira Silva, La´ercio Gomes// EPUSP. – 2007. – Vol.18, №6. – Р.12 16.
6. Wanzhong Zhang Synthesis of silver nanoparticles—Effects of concerned parameters in water/oil microemulsion/Wanzhong Zhang, Xueliang Qiao, Jianguo Chen// State Key Laboratory of Material Processing and Die & Mould Technology. 2007. – Р.17 – 21.
7. Вегера, А.В. Синтез и физико-химические свойства наночастиц серебра/
А.В. Вегера, А.Д. Зимон// Московский государственный университет технологии и управления. – 2006. - 5 – 12.
8. Степанов А.Л. Особенности синтеза металлических наночатиц в диэлектрике методом ионной имплантации/ А.Л.Степанов //Журнал Технического университета Аахена, Германия. – 2007. – С.2 – 7.
9. Комаров С.М. Камера обскура для нанотехнолога/С.М.Комаров//Химия и жизнь. - 2007. – №3. – С.32 36.
10. Эрлих Г. Нанотехнологии как национальная идея/Г.Эрлих//Химия и жизнь. - 2008. - №3. – С.32 – 38.
11. Третьяков, Ю.Д. Неорганическая химия – основа новых материалов/Ю.Д.Третьяков//Химия и жизнь. 2007. - №5. – С.4 – 11.
12. Paul Mulvaney Surface Chemistry of Coiioidai Silver in Aqueous Solution: Observations on Chemisorption and Reactivity/ Paul Mulvaney, Thomas Linnert, Arnim Henglein// The Journal of Physical Chemistry, Berlin. - 1991. - Vol. 95, 20. – Р.36 – 36.
13. Шабанова, Н.А. Химия и технология нанодисперсных систем/ Н.А.Шабанова, В.В.Попов, П.Д.Саркизов. – М.:ИКЦ «Академкнига», 2007. 309с.
© 2010 Интернет База Рефератов